题目内容
(5分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中常用到活性炭,其作用是__________________。
(2)水常用来配制各种溶液,氯化铁溶液中的溶质为___________(写化学式)。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,稀释后溶液的质量为________g。
(4)根据下表回答问题。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度 /g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
77.3 |
①40 ℃时,向两个分别盛有40 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为不饱和溶液的是____________溶液。
②采用一种操作方法,将上述的不饱和溶液变为饱和溶液。下列说法正确的是________(填字母序号)。
A.溶质的质量一定不变 B.溶液中溶质的质量分数一定增大
C.溶液质量可能不变 D.可升高温度或减少溶剂
(1)吸附 (2)FeCl3 (3)500g (4)①NH4Cl ② C
【解析】
试题分析:(1)活性炭具有疏松多孔的结构,故有较强的吸附性,能吸附色素和异味。
(2)氯化铁溶液中的溶质为氯化铁,氯化铁中铁元素的化合价为+3,氯元素的化合价为-1,故氯化铁的化学式为FeCl3。
(3)溶液加水稀释前后,溶质的质量不变;可设稀释后溶液的质量为x,则300g×25%=15%x,解得x=500g。
(4)①根据表格可知,在40℃时氯化钠的溶解度为36.6g<40g,氯化铵的溶解度为45.8g>40g,即在40℃时,向两个分别盛有40g NaCl和NH4Cl的烧杯中,各加入100g的水,充分溶解后,40g NaCl不能完全溶解,故为饱和溶液;而此时100g的水中能溶解45.8gNH4Cl,故为不饱和溶液的是 NH4Cl溶液。
②要将氯化铵的不饱和溶液变为饱和溶液,若采用加入溶质的方法,则溶质可能改变;若采用蒸发溶剂的方法,则溶剂和溶液的质量变小;若采用降低温度的方法(由表格可知,氯化铵的溶解度随温度的升高而增大),则溶质、溶剂、溶液的质量都不变,则溶质质量分数不变,故选C。
考点:水的净化,溶液、溶质和溶剂的相互关系与判断,饱和溶液和不饱和溶液,饱和溶液和不饱和溶液相互转变的方法,固体溶解度的影响因素,用水稀释改变浓度的方法
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,主要强调了学生整合知识的能力,以及对所给信息的分析、提炼、加工、运用的能力。当然,解决问题的关键还是要熟练掌握相关的基础化学知识,所以在日常学习中要多练习。

(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的_______性。
(2)根据图中实验只生成了氢气和氧气,确定水是由氢元素和氧元素组成的,得到此结论的依据是________。写出此实验中发生反应的化学方程式________。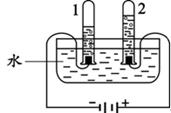
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
① 65℃时,该溶液是否为饱和溶液? (填“是”、“否”或“无法判断”);
②将t℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的是 (填字母序号);
A. 升温 B. 降温 C. 加溶质M
D. 加水 E. 加另一种固体N F. 恒温蒸发水
G. 与t℃时M的饱和溶液混合
③ 20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码)、烧杯、 。
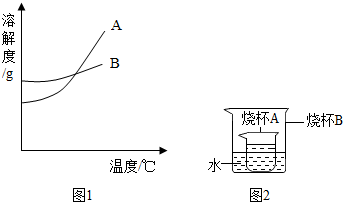 (2013?通州区一模)水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
(2013?通州区一模)水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题: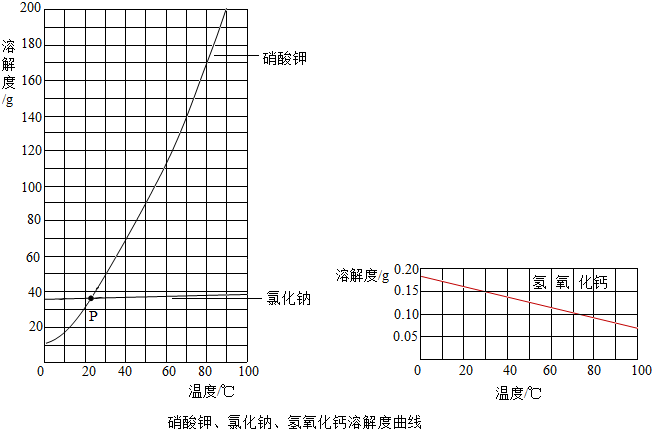
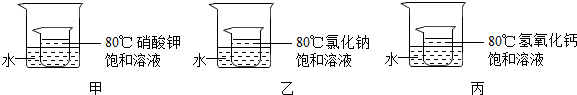
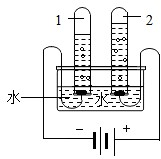 (2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.
(2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.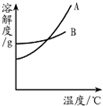 水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与
水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与