题目内容
【题目】早在春秋战国时期,我国就开始生产和使用铁器。从1世纪起,铁成了一种最主要的金属材料,工业上可利用一氧化碳还原赤铁矿制得金属铁。
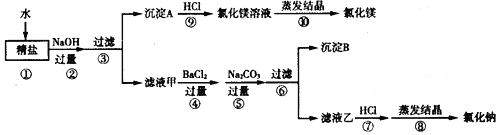
(1)如图回答问题:

①加热一段时间后玻璃管内的现象是______,反应的化学方程式为______。
②你认为B装置的优点是______。
(2)某钢铁厂用1000t80%的赤铁矿冶炼生铁,最终能得到含铁97%的生铁多少吨_____?(结果保留一位小数)
【答案】红色固体变黑, Fe2O3+3CO![]() 2Fe+3CO2 收集一氧化碳,防止污染空气(合理即可) 577.3t.
2Fe+3CO2 收集一氧化碳,防止污染空气(合理即可) 577.3t.
【解析】
(1)①氧化铁与一氧化碳在高温条件下生成铁和二氧化碳,加热一段时间后玻璃管内的现象是红色固体变黑,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②你认为B装置的优点是收集一氧化碳,防止污染空气(合理即可)。
(2)设:可得到含Fe97%的生铁的质量为x。

![]() x≈577.3t.
x≈577.3t.
答:理论上可日产含Fe98%的生铁577.3t。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目