题目内容
某“石头纸”的主要成分是碳酸钙,小明取该纸样品80g于烧杯中,加入足量稀盐酸,充分反应后,测得共生成22g气体.(假设样品中其他成分不与稀盐酸反应,且气体全部逸出)请计算:该“石头纸”样品中碳酸钙的质量分数是多少?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据反应的化学方程式,由放出二氧化碳的质量计算样品中碳酸钙的质量,即可求得样品中碳酸钙的质量分数.
解答:解:设80g样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 22g
=
X=50g
×100%=62.5%
答:碳酸钙的质量分数为62.5%
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 22g
| 100g |
| x |
| 44 |
| 22g |
X=50g
| 50g |
| 80g |
答:碳酸钙的质量分数为62.5%
点评:本题考察的是根据化学方程式计算,应熟练掌握计算格式和计算步骤.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
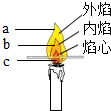 某同学对蜡烛及其燃烧进行了探究,按要求填写.
某同学对蜡烛及其燃烧进行了探究,按要求填写.