题目内容
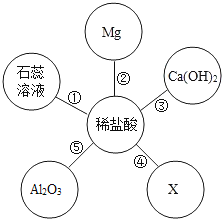
【题目】化学与我们的生活息息相关。

(1)为延长食品保质期,常采用真空包装或者充气包装,其目的主要是让食品与_____隔绝。充入食品包装袋中的气体最可能是下列气体中的____。
A 氢气 B 氮气 C 一氧化碳 D 氨气
(2)生活中,常用____鉴别硬水和软水,活性炭在净水器中能起到过滤和____的作用。
(3)目前,广泛使用的手机锂电池负极材料大多采用石墨材料,利用其____性。正极方面多是钴酸锂(LiCoO2),钴酸锂中锂元素的化合价为+1,则钴元素的化合价为____。
(4)“共享汽车”是指许多人合用一辆车。

① “共享汽车”的行李箱盖是镁铝合金,现将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度____铝的硬度(填“大于”或“小于”)
②相较于私家车而言,使用“共享汽车”出行的好处有______(填序号)
A 降低出行成本 B 减少汽车尾气排放 C 节约能源 D 降低交通压力
③ “共享汽车”使用天然气作为燃料,其主要成分是甲烷(CH4),CH4中H的质量分数为______,CH4燃烧的化学方程式是______,该过程主要是将化学能转化为_______能。
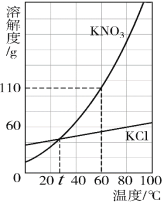
(5)图为KNO3 和NaCl两种物质的溶解度曲线图。
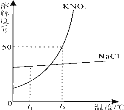
① t1℃时,两种物质溶解度的大小关系:NaCl____KNO3(填“>”或“=”或“<”)。
② t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得NaCl_____溶液(填“不饱和”或“饱和”或“不能确定”)。
③ 将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),还可以是_____。
④ 将t2℃时饱和的KNO3溶液100 g恒温蒸发10 g水,可析出KNO3 ____ g,剩下的溶液中溶质的质量分数为_____(结果保留一位小数)。
【答案】氧气(O2) B 肥皂水 吸附 导电 +3 大于 ABCD 25% CH4+2O2![]() CO2 +2H2O 热 > 饱和 升高温度 5 33.3%
CO2 +2H2O 热 > 饱和 升高温度 5 33.3%
【解析】
(1)因为氧气具有氧化性,食品和氧气接触,食品容易变质,为延长食品保质期,常采用真空包装或者充气包装,其目的主要是让食品与氧气(或O2)隔绝。因为一氧化碳有毒,氨气有刺激性气味,且对人体有害,氢气具有可燃性,遇明火容易引起爆炸,所以充入食品包装袋中的气体不可能是:氢气、一氧化碳和氨气,最可能是:氮气。故选B。
(2)因为水样中加入肥皂水,振荡,如果泡沫多,浮渣少就是软水,如果泡沫少,浮渣多就是硬水,因此生活中,常用肥皂水鉴别硬水和软水,活性炭具有吸附性,因此活性炭在净水器中能起到过滤和吸附的作用。
(3)石墨具有导电性,因此广泛使用的手机锂电池负极材料大多采用石墨材料,利用其导电性。正极方面多是钴酸锂(LiCoO2),钴酸锂中锂元素的化合价为+1,根据化合物中各元素化合价的代数和为0,设钴元素的化合价为x,则(+1)+x+(-2)×2=0。X=+3。
(4)①将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度大于铝的硬度;
②相较于私家车而言,使用“共享汽车”能够降低出行成本、减少汽车尾气排放、节约能源、降低交通压力,因此使用“共享汽车”出行的好处有:ABCD;
③ “共享汽车”使用天然气作为燃料,其主要成分是甲烷(CH4),CH4中H的质量分数为![]() ,CH4燃烧的化学方程式是:
,CH4燃烧的化学方程式是: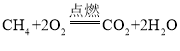 ,该过程主要是将化学能转化为热能。
,该过程主要是将化学能转化为热能。
(5)图为KNO3 和NaCl两种物质的溶解度曲线图。
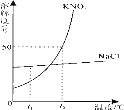
①从溶解度曲线图中可以看出, t1℃时,两种物质溶解度的大小关系:NaCl>KNO3。
② 因为t2℃时,氯化钠的溶解度小于50g,将25g氯化钠固体投入50g水中,充分溶解后氯化钠有剩余,因此可得NaCl饱和溶液。
③ 将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),因为KNO3的溶解度随温度升高而增大,因此还可以是:升高温度。
④t2℃时KNO3的溶解度是50g,根据溶解度的含义,将t2℃时饱和的KNO3溶液100 g恒温蒸发10 g水,可析出KNO3的质量为5g,因剩下的溶液仍然是t2℃时的饱和溶液,可根据溶解度计算出该温度时的饱和溶液质量分数,因此剩下的溶液中溶质的质量分数为:![]() =33.3%。
=33.3%。