题目内容
【题目】日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金,可用于武器制造。将22g弹壳(只含有锌和铜)放在盛有100g稀硫酸(足量)的烧杯中,当弹壳不再溶解后,烧杯中混合物的质量是121.8g。计算:
(1)产生氢气的质量 g。
(2)弹壳中铜的质量。
(3)反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。
【答案】(1)0.2;(2)弹壳中铜的质量为15.5g;(3)反应后所得溶液中ZnSO4的质量分数为15.1%。
【解析】
(1)根据质量守恒定律可知,反应前后的总质量的差值即为生成氢气的质量,所以生成氢气的质量=22g+100g121.8g=0.2g,故填0.2。
(2)解:设黄铜中锌的质量为x,生成硫酸锌的质量为y。
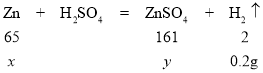
![]() x=6.5g
x=6.5g
![]() y=16.1g
y=16.1g
弹壳中铜的质量=22g6.5g=15.5g
所得硫酸锌溶液的溶质质量分数=![]() ×100%≈15.1%
×100%≈15.1%
答:(2)弹壳中铜的质量为15.5g;
(3)所得硫酸锌溶液的溶质质量分数为15.1%。

练习册系列答案
相关题目