题目内容
【题目】某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:
如图所示:在由两个注射器组成的密闭系统内共有25mL空气,然后给装有红磷的玻璃管加热.同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化后停止加热,待冷却至室温,将气体全部推至一个注射器内.回答下列问题:
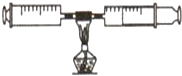
(1)在实验的加热过程中,交替缓慢推动两个注射器的目是 .
(2)写出红磷燃烧的化学反应方程式 .
(3)小组测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出他测定的空气中氧气的体积分数 2l%(填“>”、“=”“<”)
造成该实验出现误差的原因可能是 (填序号).
A.没有交替缓缓推动两个注射器活塞;
B.读数时没有冷却至室温;
C.加入红磷量太少;
D.装置漏气
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是 .
【答案】(1)使空气中的氧气充分与铜发生反应;
(2)4P+5O2![]() 2P2O5;
2P2O5;
(3)<;①②③④;
(4)利用化学反应除去混合物中的一种成分,再测量混合物在反应前后体积或质量的变化,从而得出该成分的含量.
【解析】(1)交替缓慢推动两个注射器的目的是使封闭空间的氧气与铜丝充分接触,使空气中的氧气与铜丝充分反应;故填:使空气中的氧气充分与铜发生反应;
(2)红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5;
2P2O5;
(3)反应前注射器内气体的体积为25mL,反应后注射器内气体的体积为22mL,则氧气的体积为3mL,则空气中氧气的体积分数为![]() ×100%=12%<2l%,造成该实验出现误差的原因可能是:①在加热过程中没有推拉注射器、②读数时没有冷却至室温、③加入红磷量太少、④装置漏气.
×100%=12%<2l%,造成该实验出现误差的原因可能是:①在加热过程中没有推拉注射器、②读数时没有冷却至室温、③加入红磷量太少、④装置漏气.
(4)根据上面的实验可知,测量混合物中某成分含量的方法是利用化学反应除去混合物中的一种成分,再测量混合物在反应前后体积或质量的变化,从而得出该成分的含量.故填:利用化学反应除去混合物中的一种成分,再测量混合物在反应前后体积或质量的变化,从而得出该成分的含量.