题目内容
【题目】据有关资料介绍,儿童缺钙会得佝偻病,成年人缺钙会得软骨病,血液中也有少量钙,它对皮肤伤口血液的凝固起着重要作用。
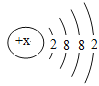
(1)钙原子结构示意图如右图所示,该原子的核电荷数为 ,它在元素周期表中位于第 周期;钙离子符号为 。
(2)钙元素的化学性质与下列哪种元素化学性质相似 ?
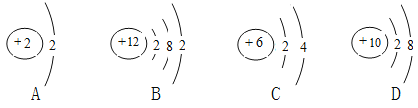
(3)若某粒子的结构示意图为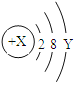 ,当X-Y=8时,该粒子的化学符号为 。
,当X-Y=8时,该粒子的化学符号为 。
(4)市场上出现的某钙片的标签如图,经检验知,此钙片中含钙物质只有碳酸钙(CaCO3)。

①此标签中标注的含钙量是否合理? (填“合理”或“不合理” )
②如果一个青少年每天需补钙0.8克,其中有0.6克来自于牛奶及其他食品,其余服用钙片。请计算每天他需补充碳酸钙多少克?
③7.4克氢氧化钙[Ca(OH)2]与多少克碳酸钙[CaCO3]含钙元素质量相等?
【答案】(1)20;四;Ca2+;(2)B;(3)S2-;(4)①不合理;②0.5g;③10。
【解析】
试题分析:(1)依据原子中质子数等于核电荷数等于核外电子数,所以可知该元素的核电荷数为2+8+8+2=20;由于电子层数与周期数相同,所以该元素是第四周期元素,由于该原子的最外层电子数是2,化学反应中易失掉最外层的两个电子,所以钙离子的符号为Ca2+;钙元素的化合价常显+2价,氯元素常显-1价,所以氯元素形成的化合物的化学式为CaCl2;
(2)由于最外层电子数相同的元素化学性质相似,观察图示可知B与钙元素的最外层电子数相等故化学性质相似;
(3)由题意知X-Y=8,故X=8+Y;在原子中X=2+8+Y,故由此可知,图中微粒为离子,即Y=8,故X=8+8=16,因此该微粒为硫离子;
(4)①碳酸钙中钙元素的质量分数为:![]() ×100%═40%
×100%═40%
每片钙片中含有钙元素的质量为:![]() =0.32g
=0.32g
0.32g<0.75g 所以:说明此标签中的含钙量不合理;
②每天需补钙元素的质量为:0.8g-0.6g=0.2g
设:每天需补充碳酸钙的质量为x
0.2g=x×40% 解得 x=0.5g;
③设7.4克氢氧化钙中所含钙元素的质量与质量为m的碳酸钙含的钙元素质量相等;则:7.4g×![]() =m×
=m×![]()
解得:m=10g
即:7.4克氢氧化钙与10克碳酸钙[CaCO3]含钙元素相等。

【题目】某兴趣小组按下图所示装置制取二氧化碳,并检验二氧化碳的性质:
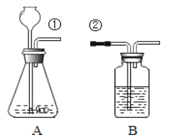
(1)若用装置B来证明二氧化碳能与水反应生成碳酸,B中除有少量水外,还应加入的试剂是 ,当①、②导管口连接时,B中看到的实验现象是 ,反应的化学方程式是 。
(2)他们从我市一古建筑维修现场搜集了一些旧墙灰,通过查阅资料得知:古建筑旧墙灰的主要成分是碳酸钙。他们称取了12.0g旧墙灰放入烧杯中,并加入足量稀盐酸(假设杂质不参与反应,不考虑H2O、HCl的逸出)。反应开始时,烧杯及所盛物质的总质量为300.0g。实验数据记录如下:
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
烧杯及所盛物质的总质量/g | 300.0 | 299.0 | 298.0 | 297.2 | 296.5 | 296.0 | 295.7 | 295.6 | M | 295.6 |
①以该小组因故没有记录反应时间为16min时的数据M,由表中数据推测,M=_______g
②反应生成二氧化碳的总质量为__________________(列出算式)。
③旧墙灰中碳酸钙的质量分数(写出计算过程)。
【题目】下列对宏观事实的微观解释正确的是
事 实 | 解 释 | |
A | 蔗糖水中的蔗糖晶体受热消失 | 蔗糖分子受热分解了 |
B | 稀硫酸和稀盐酸都能使紫色石蕊溶液变红 | 它们在水溶液中解离出的阳离子都是H+ |
C | 湿衣服在阳光下晾晒变干 | 水分子受热变成了氧气分子和氢气分子 |
D | 装有红磷的密闭氧气瓶,点燃其中的红磷后,质量不变 | 反应前后瓶中分子总数不变 |