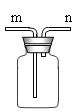
题目内容
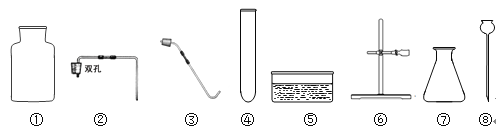
【题目】某兴趣小组按下图所示装置制取二氧化碳,并检验二氧化碳的性质:
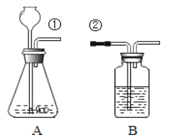
(1)若用装置B来证明二氧化碳能与水反应生成碳酸,B中除有少量水外,还应加入的试剂是 ,当①、②导管口连接时,B中看到的实验现象是 ,反应的化学方程式是 。
(2)他们从我市一古建筑维修现场搜集了一些旧墙灰,通过查阅资料得知:古建筑旧墙灰的主要成分是碳酸钙。他们称取了12.0g旧墙灰放入烧杯中,并加入足量稀盐酸(假设杂质不参与反应,不考虑H2O、HCl的逸出)。反应开始时,烧杯及所盛物质的总质量为300.0g。实验数据记录如下:
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
烧杯及所盛物质的总质量/g | 300.0 | 299.0 | 298.0 | 297.2 | 296.5 | 296.0 | 295.7 | 295.6 | M | 295.6 |
①以该小组因故没有记录反应时间为16min时的数据M,由表中数据推测,M=_______g
②反应生成二氧化碳的总质量为__________________(列出算式)。
③旧墙灰中碳酸钙的质量分数(写出计算过程)。
【答案】(1)石蕊试液;石蕊试液由紫变红;CO2+H2O=H2CO3;
(2)①295.6;
②300.0g-295.6g=4.4g
③设12.0g旧墙灰中含碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
![]() 解得:x=10g
解得:x=10g
故旧墙灰中碳酸钙的质量分数=![]() ×100%=83.3%
×100%=83.3%
【解析】
试题分析:(1)要证明二氧化碳能与水反应生成碳酸,可用紫色石蕊试液,依据是酸能使紫色石蕊变红色,二氧化碳与水反应生成碳酸的化学方程式为:CO2+H2O=H2CO3;
(2)①根据表格中的数据信息,在反应14秒和18秒时,烧杯中盛有的量均为295.6g,所以16秒时的量一定,故M为295.6g;
②根据质量守恒定律可知,烧杯及烧杯内物质减少的质量即为二氧化碳的质量,故生成的二氧化碳的质量为:300.0g-295.6g=4.4g;
③设12.0g旧墙灰中含碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
![]() 解得:x=10g
解得:x=10g
故旧墙灰中碳酸钙的质量分数=![]() ×100%=83.3%
×100%=83.3%
答:此旧墙灰中碳酸钙的质量分数83.3%