题目内容
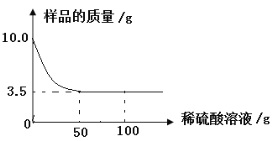
【题目】(9分)已知硫酸钾,氯化钾的水溶液都呈中性,根据下图所示的信息计算:

(1)加入的稀硫酸溶液的质量为 克。
(2)反应后所得溶液的溶质质量分数。
(3)拓展:若用等质量等质量分数的盐酸代替稀硫酸,充分反应后测定溶液的酸碱度,你认为pH 7(填>或=或<),理由是 。
【答案】(1)31 (2)10% (3)< 盐酸有剩余
【解析】
试题分析:(1)根据质量守恒定律,加入的稀硫酸溶液的质量=87g-56g=31g
(2)根据化学方程式:H2SO4+2KOH=K2SO4+H2O中KOH与K2SO4的质量关系,可计算出K2SO4的质量,进一步计算反应后所得溶液的溶质质量分数
解:设反应后生成K2SO4的质量为x
H2SO4 + 2KOH = K2SO4 + H2O
112 174
56g×10% x
112:174=56g×10%:x
x=8.7g
反应后所得溶液的溶质质量分数=8.7g/87g×100%=10%
(3)可以根据中和反应的实质:H++OH-=H2O,若用等质量等质量分数的盐酸代替稀硫酸,充分反应后判断溶液的酸碱度,实际只需比较等质量等质量分数的盐酸和稀硫酸中所含H+的质量,HCl中所含H的质量分数=1/36.5×100%,H2SO4中所含H的质量分数=2/98×100%,即等质量等质量分数的盐酸和稀硫酸中HCl中所含H的质量分数更大,所以充分反应后测定溶液的酸碱度,pH<7, 理由是:盐酸有剩余,或HCl有余

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目