题目内容
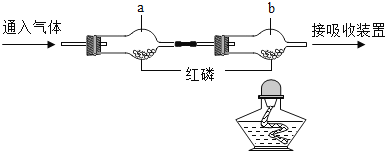
【题目】利用下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物。己知由A装置制取的CO气体中混有少量的C02。
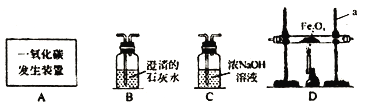
⑴仪器a的名称为________。
⑵气体通过装置的顺序是A→________(装置不能重复使用)。
⑶D装置的玻璃管里可观察到的现象为______,该反应的化学方程式________。
⑷从环保角度考虑,对以上装置的改进措施是___________。
⑸实验结束后,、若要确定C装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。__________(提示:Na2CO3溶液呈碱性)
⑹称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.lg(不包括烧杯的质量,且气体的溶解忽略不计)。试计算:
①生成二氧化碳是______②石灰石中杂质的质量分数是_________。
【答案】 铁架台 C→D→B 固体粉末由红棕色变黑 Fe2O3+3CO![]() 2Fe+3CO2 将尾气点燃或进行收集等 取少量C装置中的溶液,加入足量的CaCl2溶液(或BaCl2溶液等),静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶液为Na2CO3和NaOH,若溶液没有变成红色,则溶质为Na2CO3 4.4 20%
2Fe+3CO2 将尾气点燃或进行收集等 取少量C装置中的溶液,加入足量的CaCl2溶液(或BaCl2溶液等),静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶液为Na2CO3和NaOH,若溶液没有变成红色,则溶质为Na2CO3 4.4 20%
【解析】⑴a是铁架台。⑵首先利用装置C除去CO气体中混有的少量C02,澄清石灰水用来鉴别二氧化碳,故装置的顺序是A→C→D→B。⑶Fe2O3+3CO![]() 2Fe+3CO2,氧化铁是红棕色固体,生成的铁因含有杂质而呈现黑色。⑷尾气中含有有毒的一氧化碳,故应该将尾气点燃或进行收集等。⑸2NaOH + CO2=== Na2CO3 + H2O,Na2CO3溶液、NaOH溶液都呈碱性,先将碳酸钠转化为沉淀,防止对氢氧化钠检验的干扰,取少量C装置中的溶液,加入足量的CaCl2溶液(或BaCl2溶液等),完全将碳酸钠转化为了沉淀,静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶液为Na2CO3和NaOH,若溶液没有变成红色,则溶质为Na2CO3 。
2Fe+3CO2,氧化铁是红棕色固体,生成的铁因含有杂质而呈现黑色。⑷尾气中含有有毒的一氧化碳,故应该将尾气点燃或进行收集等。⑸2NaOH + CO2=== Na2CO3 + H2O,Na2CO3溶液、NaOH溶液都呈碱性,先将碳酸钠转化为沉淀,防止对氢氧化钠检验的干扰,取少量C装置中的溶液,加入足量的CaCl2溶液(或BaCl2溶液等),完全将碳酸钠转化为了沉淀,静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶液为Na2CO3和NaOH,若溶液没有变成红色,则溶质为Na2CO3 。
⑹①根据质量守恒定律,生成二氧化碳的质量为:12.5g+50g-58.1g=4.4g。
②设石灰石中所含碳酸钙的质量为x。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
x 4.4g
![]() =
=![]() ,解得 x=10g
,解得 x=10g
石灰石中杂质的质量分数是: ![]() ×100%=20%
×100%=20%