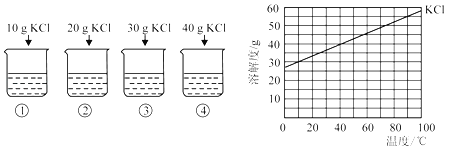
题目内容
【题目】海水中含有丰富的氯化镁。下图是从海水中提取镁的简单流程。
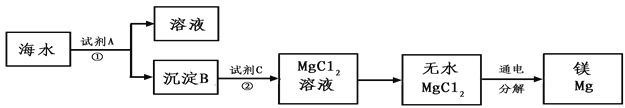
(1)上述提取Mg的过程中,试剂A最好选用______。(从节约成本角度考虑)操作①为______
(2) 沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ________,由无水MgCl2制取Mg的化学方程式为 _________电解无水MgCl2的过程中________能转化为______能。
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:______。
【答案】 Ca(OH)2或熟石灰 过滤 Mg(OH)2 MgCl2== Mg+Cl2↑ 电能 化学能 海水中含氯化钠、氯化镁等多种杂质
【解析】本题考查了酸碱盐之间的相关反应,是复分解反应发生条件的具体应用,可根据复分解反应发生条件进行分析。
(1)氯化镁转化为氢氧化镁需要加入碱溶液提供氢氧根,熟石灰的价格低廉。此处选择过量的Ca(OH)2(或熟石灰)进行反应,目的是让所取海水中的氯化镁全部转化为氢氧化镁沉淀,操作①是将混合物分离成溶液和沉淀B,应用过滤;
(2)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁,化学式为Mg(OH)2;产物为氯化镁,氯化镁在通电条件分解生成镁和氯气,反应的化学反应方程式是MgCl2通电Mg+Cl2↑,电解无水MgCl2的过程中电能转化为化学能;
(3)海水中含氯化钠、氯化镁等多种杂质,通过步骤①、②得到的MgCl2溶液浓度和纯度较高。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目