题目内容
【题目】某化学兴趣小组对“空气中氧气含量的测定”展开探究.
(1)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1、图2),红磷燃烧的符号表达式为 . 兴趣小组用该方法测出的氧气含量常常远低于21%.
(2)【实验改进】甲同学认为误差主要是由实验装置造成的,于是改用图3装置进行实验. 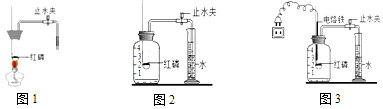
a.按图2装置实验,实验开始前应先进行的一步操作是 . 实验中燃烧匙内盛放红磷的量必须 .
b.按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源.与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是 .
(3)【提出问题】在操作规范的情况下,用改进后的装置测得的氧气含量约为14%.为什么测量结果与真实值仍有较大差距呢?
【查阅资料】燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧.引起本实验的误差除装置外,还与可燃物的性质有关.
【实验探究1】乙同学利用图4装置测定空气中氧气的含量.其中与集气瓶相连的压强传感器等电子设备能将集气瓶内压强精确地记录并保存下来.图5是用该装置测得的木炭在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P是反应结束时恢复到室温时集气瓶内的气压).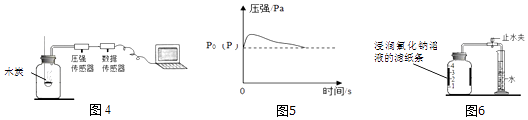
a.反应开始时集气瓶中压强会瞬间(填“变大”、“变小”或“不变”),原因是 .
b.根据图5,木炭不可代替红磷测定空气中氧气含量的原因是 .
(4)【实验探究2】已知常温下铁与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3),在有氯化钠、炭粉存在条件下,反应速度较快.丙同学根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,设计了图6所示实验装置,8分钟后测得数据如下表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
262mL | 180.0mL | 127.2mL |
丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是 .
(5)根据表中数据计算空气中的氧气含量.(写出计算过程,计算结果保留到0.1%)
【结论与反思】通过上述实验探究,选择合适的物质和实验装置进行实验,可较为快速地完成实验并减小实验误差.
【答案】
(1)4P+5O2 ![]() 2P2O5
2P2O5
(2)检查装置气密性;足量或过量;改进后的装置无需打开瓶塞点燃红磷,避免瓶内空气外逸而而造成实验误差
(3)变大;木炭燃烧放热,使瓶内温度升高,压强增大;木炭燃烧虽消耗氧气但生成二氧化碳,反应前后瓶内压强并未发生明显变化
(4)增大反应物之间的接触面积
(5)氧气的体积=180.0mL﹣127.2mL=52.8mL,氧气的含量= ![]() ×100%=20.2%;
×100%=20.2%;
【解析】解:
【实验回顾】红磷在空气中燃烧生成五氧化二磷,红磷燃烧的化学方程式为:4P+5O2 ![]() 2P2O5;a.为了保证测定结果,实验开始前应先进行装置气密性的检验,为了将空气中的氧气耗尽,实验中燃烧匙内盛放红磷的量必须足量或过量;b.按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源.与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是改进后的装置无需打开瓶塞点燃红磷,避免瓶内空气外逸而而造成实验误差;(3)图5中反应开始时集气瓶中压强瞬间变大的原因是木炭燃烧放热,导致集气瓶中的微粒之间的间隔变大,从而导致压强增大.(4)该实验中不能用木炭燃烧测定空气中氧气含量,这是因为木炭燃烧生成二氧化碳气体,会导致水不能进入集气瓶.(5)丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是增大反应物之间的接触面积;(6)氧气的体积=180.0mL﹣127.2mL=52.8mL,氧气的含量=
2P2O5;a.为了保证测定结果,实验开始前应先进行装置气密性的检验,为了将空气中的氧气耗尽,实验中燃烧匙内盛放红磷的量必须足量或过量;b.按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源.与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是改进后的装置无需打开瓶塞点燃红磷,避免瓶内空气外逸而而造成实验误差;(3)图5中反应开始时集气瓶中压强瞬间变大的原因是木炭燃烧放热,导致集气瓶中的微粒之间的间隔变大,从而导致压强增大.(4)该实验中不能用木炭燃烧测定空气中氧气含量,这是因为木炭燃烧生成二氧化碳气体,会导致水不能进入集气瓶.(5)丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是增大反应物之间的接触面积;(6)氧气的体积=180.0mL﹣127.2mL=52.8mL,氧气的含量= ![]() ×100%=20.2%;
×100%=20.2%;
答案:【实验回顾】4P+5O2 ![]() 2P2O5;
2P2O5;
【实验改进】a.检查装置气密性;足量或过量;b.改进后的装置无需打开瓶塞点燃红磷,避免瓶内空气外逸而而造成实验误差;(3)大;木炭燃烧放热,使瓶内温度升高,压强增大;(4)木炭燃烧虽消耗氧气但生成二氧化碳,反应前后瓶内压强并未发生明显变化;(5)增大反应物之间的接触面积;(6)20.2%.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

【题目】在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下表:下列说法错误的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 5 | 2 | 20 | 22 |
反应后质量/g | 待测 | 11 | 28 | 5 |
A.该反应是分解反应 B.甲可能是该反应的催化剂
C.乙、丙变化的质量比为9:8 D.反应后甲的质量为0.25