题目内容
【题目】下列物质有一种与其他三种不同的是( )
A.碳酸钙 B.硫酸钾 C.氧化铝 D.高锰酸钾
【答案】C
【解析】碳酸钙属于盐类物质,硫酸钾属于盐类物质,氧化铝属于金属氧化物,高锰酸钾属于盐类物质,故氧化铝与其他三种物质的类别不同,故选C.

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】某化学兴趣小组对“空气中氧气含量的测定”展开探究.
(1)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1、图2),红磷燃烧的符号表达式为 . 兴趣小组用该方法测出的氧气含量常常远低于21%.
(2)【实验改进】甲同学认为误差主要是由实验装置造成的,于是改用图3装置进行实验. 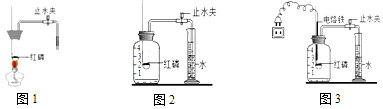
a.按图2装置实验,实验开始前应先进行的一步操作是 . 实验中燃烧匙内盛放红磷的量必须 .
b.按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源.与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是 .
(3)【提出问题】在操作规范的情况下,用改进后的装置测得的氧气含量约为14%.为什么测量结果与真实值仍有较大差距呢?
【查阅资料】燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧.引起本实验的误差除装置外,还与可燃物的性质有关.
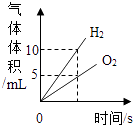
【实验探究1】乙同学利用图4装置测定空气中氧气的含量.其中与集气瓶相连的压强传感器等电子设备能将集气瓶内压强精确地记录并保存下来.图5是用该装置测得的木炭在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P是反应结束时恢复到室温时集气瓶内的气压).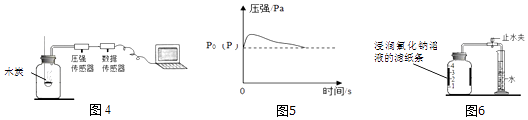
a.反应开始时集气瓶中压强会瞬间(填“变大”、“变小”或“不变”),原因是 .
b.根据图5,木炭不可代替红磷测定空气中氧气含量的原因是 .
(4)【实验探究2】已知常温下铁与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3),在有氯化钠、炭粉存在条件下,反应速度较快.丙同学根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,设计了图6所示实验装置,8分钟后测得数据如下表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
262mL | 180.0mL | 127.2mL |
丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是 .
(5)根据表中数据计算空气中的氧气含量.(写出计算过程,计算结果保留到0.1%)
【结论与反思】通过上述实验探究,选择合适的物质和实验装置进行实验,可较为快速地完成实验并减小实验误差.
【题目】甲乙两化学兴趣小组的同学按课本上的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气的体积分数存在误差.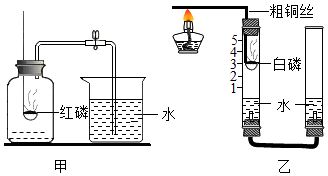
请你参与探究:
甲组测出氧气的体积分数小于五分之一
【提出问题】造成误差的原因是什么?如何改进课本上的实验装置?
【查阅资料】红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(1)【猜想与假设】A同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性.
B同学:可能是瓶内残留气体中还有氧气.
你还能作出的猜想是 .
(2)【交流与讨论】①他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略).
与课本上的实验装置相比较,该装置的一个优点是 .
②能得出空气中氧气约占五分之一体积的实验现象是 .
乙组同学从课本镁条燃烧实验得到启发,用镁代替红磷,实验完毕,冷却后进入水的体积远大于总容积的1/5.
(3)【猜想与假设】可能镁条与氮气发生了反应
【设计实验】为检验镁条能否在N2中燃烧,兴趣小组展开如下探究: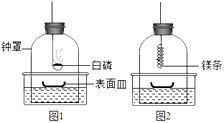
①组装仪器(图1,钟罩下端无底),检查气密性:向水槽中加水,观察到现象,说明气密性良好;
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞;
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2),观察液面变化;
【交流讨论】
a.步骤①气密性良好的现象是;
b.步骤②目的是;
c.步骤④观察到现象,说明镁条与氮气反应.
(4)【反思】乙组小罗同学认为只进行图2实验,当钟罩内进入水的体积大于总容积的 ![]() ,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确并说明理由 .
,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确并说明理由 .
(5)【拓展】①镁与氮气反应生成氮化镁(Mg3N2),由于氧气比氮气活泼,所以镁燃烧生成的氮化镁质量比氧化镁(大、小).
②8g镁在空气中燃烧,若有30%的镁生成氮化镁,计算氮化镁的质量 (写出计算过程).