题目内容
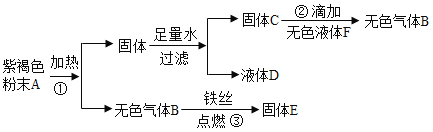
【题目】碱式碳酸锌的组成测定。为确定碱式碳酸锌[aZnCO3·bZn(OH)2·cH2O]的组成,现称取35.9g样品进行如下实验。

(资料)①Zn(OH)2加热至125℃、ZnCO3加热至350℃分别分解生成两种氧化物。该碱式碳酸锌失去结晶水的温度与Zn(OH)2的分解温度接近。
②浓硫酸具有吸水性,NaOH溶液能充分吸收CO2,碱石灰能充分吸收CO2和H2O。
(1)装配好实验装置后,先要______________。
(2)加热前后及过程中均通入氮气,停止加热后继续通氮气的目的是___________。
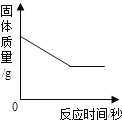
(3)控制温度在不同的范围对A中样品加热。测得装置B、C的质量在实验前后的变化情况如下表所示,测得A中剩余固体质量随温度的变化如下图所示。
装置 | 实验前/g | 实验后/g |
B | 198.0 | 205.2 |
C | 221.0 | 225.4 |

①m=________g。
②a:b:=_________。
③如缺少装置D,会导致________(选填“a”、“b”或“c”)测定结果偏大。
【答案】检查装置的气密性 防止液体倒吸 24.3 1:2 a
【解析】
(1)装配好实验装置后,先要检查装置的气密性;
(2)加热前后及过程中均通入氮气,停止加热后继续通氮气的目的是防止液体倒吸;
(3)①B装置的浓硫酸吸收水的质量为205.2g-198.0g=7.2g;C装置的NaOH溶液吸收二氧化碳的质量为225.4g-221.0=4.4g;产生的水和二氧化碳的质量即为固体减少的质量,故m=28.7g-4.4g=24.3g;
②一分子碳酸锌产生一分子二氧化碳,一分子氢氧化锌产生一分子水,而产生二氧化碳质量为4.4g,产生的水的质量为7.2g,故a=1,b=2,c=2;故a:b=1:2;
③D装置的作用是防止空气中的二氧化碳和水蒸气进入装置C,那么装置C吸收了一部分空气中的二氧化碳,增重大于实际分解得到的二氧化碳,使a的实验结果偏大。

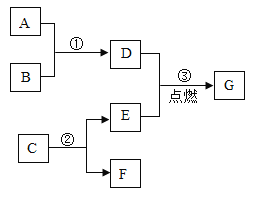
【题目】下列化学知识归纳整理的相关内容中完全正确的一组是( )
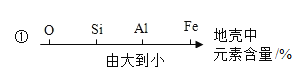
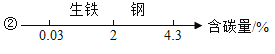
A数轴表示 | B化学中常见的“三” |
① ② | ①三种可燃性气体: H2、CO、O2 ②三大天然矿物燃料:煤、石油、天然气 |
C实验操作的先后顺序 | D化学与安全 |
①点燃可燃性气体------------先验纯后 点燃 ②CO还原CuO------------先通入 CO后加热 | ①在室内放一盆水,可防止煤气中毒 ②为防止矿井中瓦斯爆炸,严禁吸烟 |
A.AB.BC.CD.D