题目内容
【题目】银白色的镁条表面常有一层灰黑色的“外衣”,某小组同学进行了如下探究:
I.甲同学认为该外衣是MgO,遭到否定,否定的理由是____________.
Ⅱ.查阅资料:镁条变黑是因为生成了碱式碳酸镁[Mgx(OH)yCO3]。
探究1:影响镁条变黑的因素
(1)根据碱式碳酸镁含有H元素,推测镁条变黑与空气中的_______有关;
(2)根据碱式碳酸镁含有C元素,推测镁条变黑与空气中的_______有关;
(3)为确认镁条变黑是否与O2有关,乙同学设计了如下实验:

同学们讨论得出:只要完成实验_______和_______(选填序)就可达到探究目的。
探究2:碱式碳酸镁[Mgx(OH)yCO3]的化学式
(资料)①碱式碳酸镁受热分解生成三种氧化物;
②NaOH溶液吸收CO2,浓H2SO4只吸收水。
(实验)将1.42g碱式碳酸镁加热至完全分解,使产生的气体全部缓缓通过下图装置,测定生成气体的质量(假设每步吸收均完全)。
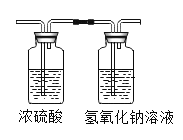
(数据)①浓硫酸增重0.18g;②NaOH 溶液增重0.44g。
(结论)x:y=____:______,碱式碳酸镁受热分解的化学方程式为_________。
(延伸)工业上碱式碳酸镁可作阻燃剂,其可能的原因是_________(选填序号)。
a分解时吸热,降低可燃物的着火点
b生成的固体覆盖燃烧物,隔绝氧气
c生成的气体稀释了可燃物周围的氧气浓度
【答案】氧化镁是白色固体 水 二氧化碳 A C 1 1 Mg2(OH)2CO3![]() 2MgO+H2O+CO2
2MgO+H2O+CO2![]() bc
bc
【解析】
I、甲同学认为该外衣是MgO,遭到否定,否定的理由是MgO是白色固体;
Ⅱ、(1)根据碱式碳酸镁含有H元素,推测镁条变黑与空气中的水有关;
(2)根据碱式碳酸镁含有C元素,推测镁条变黑与空气中的二氧化碳有关;
(3)如果实验A中的镁条不变黑色,实验C中的镁条变黑色,则可以证明镁条的变黑与氧气有关;如果实验A中的镁条变黑,实验C的镁条也变黑,则可以证明镁条的变黑与氧气无关,故只要完成实验A、C即可完成探究;
[结论]因为浓硫酸增重了0.18g,故分解产生的水为0.18g;氢氧化钠溶液增重了0.44g,故分解产生的二氧化碳为0.44g;且根据化学式可知一分子碱式碳酸镁生成一分子二氧化碳,二氧化碳的相对分子质量为44,水的相对分子质量为18,故一分子碱式碳酸镁也生成一分子水,则y=2;根据正负化合价的代数和为0 ,碳酸根的化合价为-2价,氢氧根的化合价为-1价,镁的化合价为+2价,可知x=2,故x:y=1:1;
碱式碳酸镁受热产生氧化镁、二氧化碳和水,则反应的化学方程式为Mg2(OH)2CO3![]() 2MgO+H2O+CO2
2MgO+H2O+CO2![]() ;
;
[延伸]a、着火点是物质的特性,不会降低,错误;
b、生成的固体:氧化镁覆盖在燃烧物上面,隔绝氧气,正确;
c、生成的气体二氧化碳和水能够稀释可燃物周围的氧气浓度,正确。
故选bc。

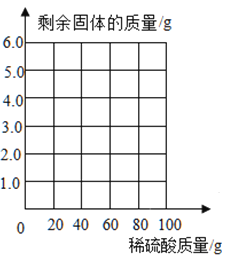
【题目】为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁,然后将100g稀硫酸平均分五次加入,测得加入稀疏酸质量与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸反应)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生氢气的累计质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是_________?(写出计算过程,结果精确到0.1%)
(3)请根据数据和计算结果,在下图坐标中画出对应的曲线图______。
【题目】碱式碳酸锌的组成测定。为确定碱式碳酸锌[aZnCO3·bZn(OH)2·cH2O]的组成,现称取35.9g样品进行如下实验。

(资料)①Zn(OH)2加热至125℃、ZnCO3加热至350℃分别分解生成两种氧化物。该碱式碳酸锌失去结晶水的温度与Zn(OH)2的分解温度接近。
②浓硫酸具有吸水性,NaOH溶液能充分吸收CO2,碱石灰能充分吸收CO2和H2O。
(1)装配好实验装置后,先要______________。
(2)加热前后及过程中均通入氮气,停止加热后继续通氮气的目的是___________。
(3)控制温度在不同的范围对A中样品加热。测得装置B、C的质量在实验前后的变化情况如下表所示,测得A中剩余固体质量随温度的变化如下图所示。
装置 | 实验前/g | 实验后/g |
B | 198.0 | 205.2 |
C | 221.0 | 225.4 |

①m=________g。
②a:b:=_________。
③如缺少装置D,会导致________(选填“a”、“b”或“c”)测定结果偏大。