题目内容
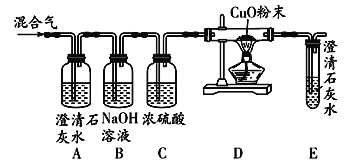
【题目】某补钙剂的主要成分是碳酸钙(其他成分不含钙元素且不与盐酸反应)。化学活动小组想测定该补钙剂中钙元素的质量分数,设计方案如图(如图所示,图中固定装置的仪器已略去);检查装置气密性良好,取10g药片研细,加入足量稀盐酸充分反应,产生气体经干燥后通入氢氧化钠溶液中,经测定C装置增重3.3g。
(1)装置D的作用是_____;
(2)该补钙剂中钙元素的质量分数是____________?写出计算过程。
(3)根据以上方案测定结果会偏低,分析原因_____。
【答案】防止空气中的二氧化碳进入C中 30% 反应生成的二氧化碳不能被氢氧化钠溶液完全吸收
【解析】
该实验通过C装置测定生成的二氧化碳的质量来计算碳酸钙的质量,然后求出钙元素质量,最后达到实验目的求出该补钙剂中钙元素的质量分数。装置中碱石灰的作用是吸收进入C中的空气中的二氧化碳,防止对二氧化碳的测定造成干扰。
(1)装置中碱石灰的作用是吸收进入C中的空气中的二氧化碳,防止对二氧化碳的测定造成干扰;
(2)取10g药片研细,加入足量稀盐酸充分反应,产生气体经干燥后通入氢氧化钠溶液中,经测定C装置增重3.3g。n(CO2)=![]() =0.075mol,由CaCO3+2HCl== CaCl2+H2O+CO2↑可知,n(CaCO3)=n(CO2)=0.075mol,m(CaCO3)=0.075mol
=0.075mol,由CaCO3+2HCl== CaCl2+H2O+CO2↑可知,n(CaCO3)=n(CO2)=0.075mol,m(CaCO3)=0.075mol![]() 100g/mol=7.5g,m(Ca)=7.5g
100g/mol=7.5g,m(Ca)=7.5g![]() =3g,该补钙剂中钙元素的质量分数=
=3g,该补钙剂中钙元素的质量分数=![]() =30%;
=30%;
(3)反应生成的二氧化碳残留,不能被氢氧化钠溶液完全吸收,会导致测定的钙元素的质量分数偏低。

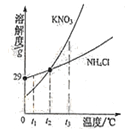
【题目】下表是固体A和固体B在不同温度时的溶解度.
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | 固体A | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
固体B | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)从表中数据可以看出固体A和固体B的溶解度随温度升高而_____(填“增大”或“减小”).
(2)20℃时,把50g固体A放入100g水中,充分溶解后,所得溶液质量为_____g.
(3)40℃时,A、B两种物质的饱和溶液中溶质的质量分数较大的是_____.
(4)若B饱和溶液中有少量的A,可用下列_____法提纯B(填序号).
①趁热过滤 ②蒸发结晶 ③冷却热饱和溶液.
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
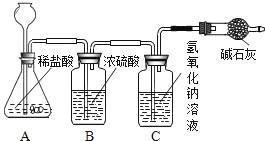
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
【题目】(I)SO2能漂白某些有色物质,如将SO2通入品红溶液中,品红溶液褪色;无水硫酸铜遇水由白色变成蓝色。
(Ⅱ)KMnO4酸性溶液具有强氧化性,易与二氧化硫发生反应,其反应原理:
5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4(无色溶液)
(Ⅲ)一些含硫物质的溶解性(20℃):
含碗物质 | K2SO4 | MnSO4 | CaSO4 | CaSO3 | FeSO4 | Fe2(SO4)3 |
溶解性 | 易溶 | 易溶 | 微溶 | 难溶 | 易溶 | 易溶 |
虚线框中的装置可用来检测浓硫酸与木炭粉在加热的条件下反应产生的所有产物(CO2、SO2、H2O)。请回答下列问题:

①仪器A的名称_____;写出A中反应的化学方程式:_____。
②装置中第a部分的作用是_____,可观察到的现象是_____,第b部分最后一个洗气瓶中品红溶液的作用是_____。
③若将装置中a、b、c三部分仪器的连接顺序改为b→a→c,则不能检出的物质是_____。
④若将仪器的连接顺序改为a→c→b,则只可检出的物质是_____。