题目内容
【题目】已知:AlC13可以与NaOH生成Al(OH)3沉淀,Al(OH)3沉淀可溶于NaOH溶液,其反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,现向100gHCl和AlC13的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示。回答下列问题:
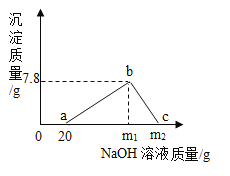
(1)oa段表示NaOH与混合溶液中的______反应。
(2)原混合溶液中HCI的质量分数是_______。
(3)当沉淀达到最大值时生成NaCl的质量是多少?(写计算过程)______
【答案】(1)HCl;
(2)3.65%;
(3)设盐酸与氢氧化钠反应生成的氯化钠质量为y;氯化铝与氢氧化钠反应生成的氯化钠质量为z;
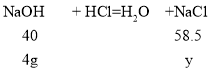
![]()
解得y=5.85g;
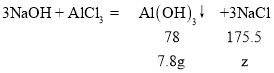
![]()
解得z=17.55g,
当沉淀达到最大值时生成氯化钠的质量=5.85g+17.55g=23.4g。
【解析】
(1)oa段无沉淀生成,应为氢氧化钠与剩余的盐酸反应。故填:HCl;
(2)由图像可知氯化氢消耗的氢氧化钠的质量为:![]() ,氢氧化铝沉淀最大质量为7.8g。
,氢氧化铝沉淀最大质量为7.8g。
设混合溶液中氯化氢的质量为x,
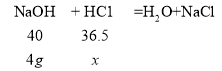
![]()
解得x=3.65g;
故原混合溶液中氯化氢的质量分数=![]() ,故填:3.65%;
,故填:3.65%;
(3)设盐酸与氢氧化钠反应生成的氯化钠质量为y;氯化铝与氢氧化钠反应生成的氯化钠质量为z;
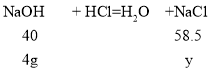
![]()
解得y=5.85g;
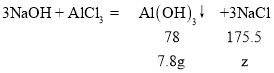
![]()
解得z=17.55g,
当沉淀达到最大值时生成氯化钠的质量=5.85g+17.55g=23.4g。

【题目】有一包白色固体,可能含有氯化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如下所示实验:
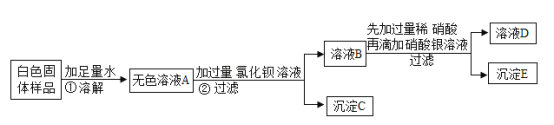
请回答下列问题:
(1)①和②都用到玻璃棒,但其作用不同。操作②中玻璃棒的作用是_____。
(2)原固体中一定不含有的物质是____(写物质名称)。
(3)为确定白色固体样品中可能存在的物质,小强对沉淀C进行实验:
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量稀硝酸 | ________ | 白色固体中有碳酸钠,没有硫酸钠 |
(4)小明同学认为白色固体中还不能确认是否存在的是_______,理由是(用化学方程式表示):________;如要说明肯定有该物质,只需将上述实验方案中所加的一种试剂改为________即可。