题目内容
在氧化铜和铁粉的混合物中加入一定量的稀硫酸,并微热,反应停止后滤出不溶物,再向滤液中放入一薄铁片,足够时间后取出,铁片无任何变化.根据上述现象判断,以下结论正确的是( )
分析:根据金属活动顺序可知向滤液中加入薄铁片,而氧化铜可以和硫酸反应生成硫酸铜,铁可以硫酸铜反应铁片无任何变化,说明没有稀硫酸,也没有硫酸铜可以据此结合题给的选项进行分析判断即可;
解答:解:A、铁可以和硫酸反应生成硫酸亚铁,所以在滤液中一定含有硫酸亚铁,但是加入铁片后铁片没有明显变化,所以可以判断滤液中没有硫酸铜,故A结论不正确;
B、题中没有提及铁粉的质量,所以反应后滤出的不溶物中可能含有铁粉,故B结论不正确;
C、加入铁片后没有明显变化,说明氧化铜和硫酸反应生成的硫酸铜被铁置换出来,故在不溶物中含有铜,故C结论不正确;
D、加入铁片后没有明显变化,说明氧化铜和硫酸反应生成的硫酸铜被铁置换出来,故在不溶物中含有铜,故D结论正确.
故选D.
B、题中没有提及铁粉的质量,所以反应后滤出的不溶物中可能含有铁粉,故B结论不正确;
C、加入铁片后没有明显变化,说明氧化铜和硫酸反应生成的硫酸铜被铁置换出来,故在不溶物中含有铜,故C结论不正确;
D、加入铁片后没有明显变化,说明氧化铜和硫酸反应生成的硫酸铜被铁置换出来,故在不溶物中含有铜,故D结论正确.
故选D.
点评:此题是一道推断知识考查题,解题的关键是对最后加入铁后无变化的分析,也就是说明反应后的溶液中不会有硫酸铜及硫酸的存在,这是解题的关键.

练习册系列答案
相关题目
在氧化铜和铁粉的混合物中,加入一定量的稀硫酸,微热,待反应停止后过滤,再向滤液中放一枚铁钉,过一会儿取出,发现铁钉无变化,根据上述现象作出的判断中正确的是( )
| A、不溶物一定是铜 | B、不溶物一定是铁 | C、滤液是硫酸亚铁溶液 | D、滤液是硫酸亚铁和硫酸铜的混合溶液 |

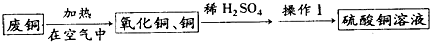
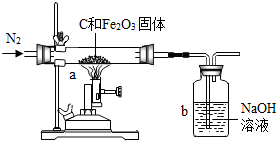 (2012?鼓楼区一模)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.
(2012?鼓楼区一模)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.