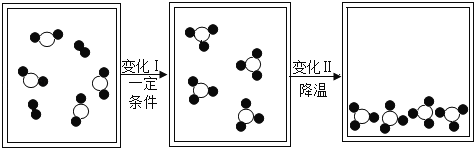
题目内容
【题目】下图1为甲、乙两种固体物质的溶解度曲线。
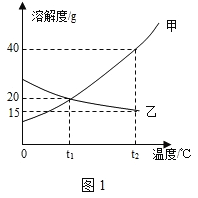
(1)溶解度随温度升高而增大的物质是________(填 “甲”或“乙”)。
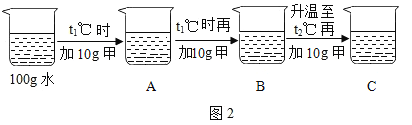
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是________(填字母)。向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为________(结果精确到0.1%)。
(3)将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数甲________乙(填“<”、“=”或“>”)。
(4)将t2℃时70 g 甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________。
【答案】甲 B 28.6% > 130g
【解析】
由溶解度曲线可知,甲物质溶解度随着温度下降而减小,乙物质溶解度随着温度下降而增大。
(1)由溶解度曲线可知,甲物质溶解度随温度升高而增大。
(2)由溶解度曲线可知,在t1℃时甲物质溶解度为20g,向100g水中加入10g甲物质形成不饱和溶液即A,再加10g甲物质形成饱和溶液即B,在t2℃时甲物质溶解度为40g,然后继续向B中加入10g甲物质,即100g水中加入30g甲,形成不饱和溶液即C,向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,只能溶解40g甲物质形成饱和溶液,所得溶液中溶质的质量分数为![]() 。
。
(3)根据溶解度曲线可知,甲物质溶解度随着温度下降而减小,乙物质溶解度随着温度下降而增大,所以将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,甲溶液中有晶体析出,计算此时溶液中溶质质量分数利用t1℃时饱和溶液溶解度,乙溶液变为不饱和溶液,降温过程中乙溶液中溶质质量分数不变,计算此时溶质质量分数利用t2℃饱和溶液溶解度,饱和溶液溶解度越大,其溶质质量分数越大,所以所得溶液中溶质的质量分数甲>乙。
(4)t2℃时,甲物质的溶解度是40g,所以将70g乙的饱和溶液稀释为质量分数为20%的溶液,需加水的质量为 。
。

【题目】某兴趣小组对氯酸钾(KClO3)分解反应的催化剂进行研究,在相同的加热条牛下,用下图装置完成表中实验:
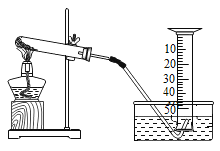
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s。 |
实验1 | 5 | --- | --- | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)编号实验2中5克氯酸钾完全分解后,MnO2的质量为________。
(2)表中所列3种催化剂的催化效果最佳的是___________。
(3)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____________。
(4)氯酸钾在加热的条件下发生分解反应,生成氯化钾与氧气,请写出编号实验2的KClO3分解的化学方程式:____________。
(5)由实验1和实验4可知,KCl_______(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:___________。