��Ŀ����
����Ŀ����֪ij��Һ�е����ʿ�����HCl��NaOH��CaCl2�е�һ�ֻ����֣�Ϊȷ������Һ�����ʵijɷּ���������������ʵ�顣
��1��ȡ������Һ���Թ��У�����2����ɫ��̪��Һ����̪����ɫ����Һ��һ��������____��
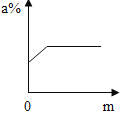
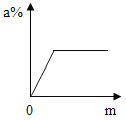
��2��Ϊ�˽�һ���ⶨ�ɷּ�����������ȡ120g��Һ���ձ��У���μ���20.0%��Na2CO3��Һ����õμ���Һ����������������Ĺ�ϵ��ͼ1���͵μ���Һ���������ձ�����Һ��pH��ϵ��ͼ2���� ����֪�� CaCl2��Һ�����ԣ��ش���������

�ٸ���Һ�����ʵĻ�ѧʽΪ_________
�ڼ�����Һ���Ȼ������������_______����д��������̣�
��m1=_____ g��m2= ____g��
���𰸡��������� HCl��CaCl2 3.65% 63.6 31.8
��������
�����̼�����ȷ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��ƺ��Ȼ��ơ�
��1�����������Լ��ԣ���ʹ��̪���ɫ��ȡ������Һ���Թ��е���2����ɫ��̪����̪����ɫ����Һ��һ���������������ơ�
��2���������̼�����ȷ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼������������ȫ��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ�������м���һ����̼���ƣ��Ż���ֳ������ʸ���Һ������Ϊ�Ȼ��⡢�Ȼ��ƣ���ѧʽΪHCl��CaCl2��
������Һ���Ȼ��������Ϊx
�����ᷴӦ��̼���Ƶ�����Ϊ![]()
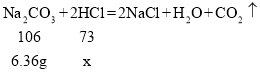
![]()
![]()
����Һ���Ȼ������������Ϊ![]()
�������Ȼ��Ʒ�Ӧ��̼��������Ϊz
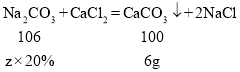
![]()
![]()
��![]() ��
��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�