��Ŀ����
����Ŀ��ͭ����������ʹ�����硢Ӧ�ù㷺�Ľ�����
(һ)�ԹŴ���Ʒ����ʶ
��ͭ������˿��֯Ʒ���մ��������ҹ��Ŵ��Ͷ�������ĻԻͳɾͣ�
(1)������Ʒ���漰���IJ�����______(ѡ�����)��
A���������� B�����ǽ������� C�����ϲ���
(2)��ͼ1Ϊ��������Ŵ���ͭ��������̤���������������ܱ��������ԭ�������_____(ѡ�����)��
A��ͭ�Ļ������� B��ͭ�������� C�������ڵ��£���������
(��)����ͭ��ұ��
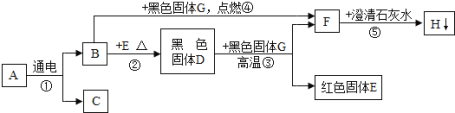
���ҹ��Ŵ����ÿ�ȸʯ��ͭ���漰��Ҫ��Ӧ�Ļ�ѧ����ʽ��_________��2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
������ͭ��ʯ�г�����(Fe2O3)��������(Fe3O4)��������(FeS2)����ͭ��(CuFeS2)�ȣ�CuFeS2Ϊ��������ͭ������SԪ�صĻ��ϼ�Ϊ______��
(1)��ҵ���������ó����������Դ�����Ϊԭ��������Ӧ�Ļ�ѧ����ʽΪ______________��
���������û�����ͭ���ܵ�ԭ���ǣ�
�ٻ�����ͭ��������Եͣ���________________________________��
(2)�Ի�ͭ��Ϊԭ�ϣ�����������ͭ���ִ���ͭ���¹��գ�ԭ��Ϊ��4CuFeS2+17O2+2H2SO4![]() 4CuSO4+2Fe2(SO4)3+2H2O��
4CuSO4+2Fe2(SO4)3+2H2O��
��������Ӧ�����Һ�м���Fe�ۣ��õ�FeSO4��Һ��Cu��
�ٷ�����Ҫ��Ӧ�Ļ�ѧ����ʽ��Fe+Fe2(SO4)3=3FeSO4��________________________��
��FeSO4��Һ������Ũ����___________�����˵Ȳ����õ�FeSO47H2O���壮
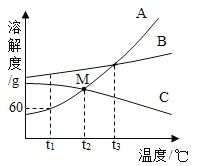
(��)��ͭ��������ͭ�����IJⶨ
�ڿ�����Աָ���£���ȤС���ȡ25.00g��ͭ��(������Fe2O3��������������Ԫ�ص�����)ģ��������ͭ��ʹ��ȫ��ת��ΪCuSO4��Fe2(SO4)3��Һ������Һ�м������NaOH��Һ�õ�Cu(OH)2��Fe(OH)3���壮
(1)֤��NaOH��Һ�����ķ��������ã����ϲ���Һ�еμ�________��Һ��������
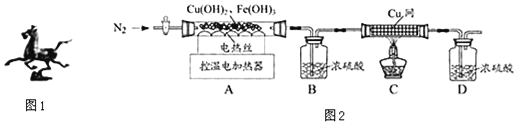
(2)��ͼ2װ�öԹ�������ȷֽ�ʵ�飮
�����ϡ�
����68��ʱ��Cu(OH)2�ֽ�ΪCuO����500��ʱ��Fe(OH)3�ֽ�ΪFe2O3��
����1400��ʱ��CuO�ֽ�ΪCu2O��O2��Fe2O3�ֽ�Ϊ���ӵ������������O2��
(1)װ���ʵ��װ�ú���Ҫ________________��
(2)ֹͣ���Ⱥ��������ͨN2���ɷ�ֹ������______________________________��
(3)���Ʋ�ͬ���¶ȶ�A�й�����ȣ����װ��B��C��ͭ���������仯�����
�¶�/�� | ���� | 100 | 550 | 1400 |
Bװ��/g | 200.00 | 201.80 | 205.04 | 205.04 |
C��ͭ��/g | 100.00 | 100.00 | 100.00 | 101.28 |
�ٴ˻�ͭ����ͭ����Ԫ�ص�������������(Cu)%=________����(Fe)%=__________��
�ڸ��ӵ����������ﻯѧʽΪ__________��
���𰸡� C AC Cu2(OH)2CO3![]() H2O+CO2��+2CuO ��2 Fe3O4+4CO
H2O+CO2��+2CuO ��2 Fe3O4+4CO![]() 3Fe+4CO2 ұ�������л�����ж��������������Ⱦ���� Fe+CuSO4=Cu+FeSO4 ���½ᾧ NaOH ���װ�õ������� ʹ���ɵ�����ȫ����B��Cװ������ 25.60% 26.88% Fe4O5
3Fe+4CO2 ұ�������л�����ж��������������Ⱦ���� Fe+CuSO4=Cu+FeSO4 ���½ᾧ NaOH ���װ�õ������� ʹ���ɵ�����ȫ����B��Cװ������ 25.60% 26.88% Fe4O5
����������һ����1����ͭ�ǺϽ����ڽ������ϣ�˿��������Ȼ���ϣ��մ��������ǽ������ϣ���2��ͭ�Ļ�������������ڵ��¸����˿�����������ͭ���������⣻�������ټ�ʽ̼��ͭ���ȷֽ���������ͭ��������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu2(OH)2CO3![]() H2O+CO2��+2CuO����CuFeS2Ϊ��������ͭ������ͭԪ����+2�ۣ���Ԫ����+2�ۣ�����Ԫ�صĻ��ϼ�Ϊx����+2��+��+2��+2x=0��x=-2��(1)��ҵ����CO�ʹ�������������Ҫ������CO�Ļ�ԭ�ԣ��ڸ����º���������Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪFe3O4+4CO
H2O+CO2��+2CuO����CuFeS2Ϊ��������ͭ������ͭԪ����+2�ۣ���Ԫ����+2�ۣ�����Ԫ�صĻ��ϼ�Ϊx����+2��+��+2��+2x=0��x=-2��(1)��ҵ����CO�ʹ�������������Ҫ������CO�Ļ�ԭ�ԣ��ڸ����º���������Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪFe3O4+4CO![]() 3Fe+4CO2���ڻ�����ͭ�������ͣ����жԻ����к���Ԫ��������ұ�������л�����ж��������������Ⱦ��������˻�����ͭ����������(2)�ټ����������������ͭ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽ�� Fe+CuSO4=Cu+FeSO4����FeSO4��Һ������Ũ�������½ᾧ�����˵Ȳ����õ�FeSO47H2O���壻������(1)�������ϲ���Һ�еμ�����������Һ���������������������Ƶ������㣬��û�г������������������Ѿ������������ϡ�(1)�������������ɵķ�Ӧ����ʵ��ǰ��һ��Ҫ���װ�õ������ԣ� (2)Ϊ��ʹ������ˮ��������������ȫ���գ�����ֹͣ���Ⱥ��������ͨN2��ʹ���ɵ�����ȫ����B��Cװ�����գ�(3)��������ͭԪ�ص�����Ϊx��������ͭ���Ȼ�ֽ�Ϊ����ͭ��ˮ������ʽΪCu��OH��2
3Fe+4CO2���ڻ�����ͭ�������ͣ����жԻ����к���Ԫ��������ұ�������л�����ж��������������Ⱦ��������˻�����ͭ����������(2)�ټ����������������ͭ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽ�� Fe+CuSO4=Cu+FeSO4����FeSO4��Һ������Ũ�������½ᾧ�����˵Ȳ����õ�FeSO47H2O���壻������(1)�������ϲ���Һ�еμ�����������Һ���������������������Ƶ������㣬��û�г������������������Ѿ������������ϡ�(1)�������������ɵķ�Ӧ����ʵ��ǰ��һ��Ҫ���װ�õ������ԣ� (2)Ϊ��ʹ������ˮ��������������ȫ���գ�����ֹͣ���Ⱥ��������ͨN2��ʹ���ɵ�����ȫ����B��Cװ�����գ�(3)��������ͭԪ�ص�����Ϊx��������ͭ���Ȼ�ֽ�Ϊ����ͭ��ˮ������ʽΪCu��OH��2 ![]() CuO+H2O�������¼��ȵ�100��ʱ��װ��B�����ص�����Ϊ������ͭ�ֽ�����ˮ������λx���������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
CuO+H2O�������¼��ȵ�100��ʱ��װ��B�����ص�����Ϊ������ͭ�ֽ�����ˮ������λx���������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
Cu��CuFeS2��CuSO4��Cu��OH��2��H2O
64 18
x ��201.80-200.00��g
![]()
x=6.4g��
��˻�ͭ����ͭԪ�ص���������������Cu��%=![]() ��100%��25.60%��
��100%��25.60%��
��������Ԫ�ص�����Ϊy�������������Ȼ�ֽ�Ϊ��������ˮ������ʽΪ2Fe��OH��3 ![]() Fe2O3+3H2O����100����ȵ�550��ʱ��װ��B�����ص�����Ϊ���������ֽ�����ˮ���������������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
Fe2O3+3H2O����100����ȵ�550��ʱ��װ��B�����ص�����Ϊ���������ֽ�����ˮ���������������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
2Fe��2CuFeS2��Fe2��SO4��3��Fe��OH��3��3H2O
112 54
y ��205.04-201.80��g
![]()
y=6.72g
��˻�ͭ������Ԫ�ص���������������Fe��%=![]() ��100%��26.88%��
��100%��26.88%��
������ͭ���ȷֽ�ķ���ʽΪ��4CuO![]() Cu2O+O2��
Cu2O+O2��
������ͭ�ֽ���������������Ϊz����
4Cu��4CuO��2Cu2O��O
256 32
6.4g z
![]()
z=0.8g��
��Ϊװ��C���ص�����Ϊ����ͭ���������ֽ�����������������������������ֽ���������������Ϊ����101.28g-100.00g-0.8g��=0.48g��������������Ϊ��6.72g��112160��100%=9.6g��
���ɵĸ��������������к���Ԫ�ص�����Ϊ��9.6g-0.48g-6.72g=2.4g��
���ӵ���������������ԭ������ԭ�ӵĸ�����Ϊ��6.72g56��2.4g16=4��5��
���ӵ����������ﻯѧʽΪ��Fe4O5��

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�