题目内容
【题目】已知在常温下A为液体,B、C、F是气体; 其中C是最轻的气体,F是造成温室效应的主要气体;G为黑色固体单质,H是白色不溶于水的固体,它们之间的转变关系如图,请回答下列问题:
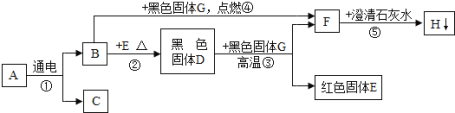
(1)写出有关物质的化学式:C是 ;G是 ;H是 。
(2)写出反应②的化学方程式 ,该反应的基本反应类型是 。
(3)写出反应③的化学方程式: 。
【答案】(1)C: H2 G:C H: CaCO3
(2)2Cu+ O2![]() 2CuO 化合反应
2CuO 化合反应
(3)2CuO + C![]() 2Cu+CO2↑
2Cu+CO2↑
【解析】
试题分析:A在通电条件下分解生成B和C,故A为水;水通电分解生成氢气和氧气,C是最轻的气体,则C为氢气;则B为氧气;F是造成温室效应的主要气体,则F为二氧化碳;G为黑色固体单质,在氧气中能燃烧生成二氧化碳,故G为碳;二氧化碳与石灰水反应生成碳酸钙沉淀,故H为碳酸钙;E为红色固体,则E为铜;铜与氧气在加热的条件下生成氧化铜,故D为氧化铜;D氧化铜和黑色固体G在高温条件下反应生成铜和二氧化碳。(1)由上述分析可知C是 H2, G是 C,H是CaCO3 ;(2)反应②为铜和氧气在加热条件下生成氧化铜,化学方程式 2Cu+O2![]() 2CuO;该反应中反应物有两种,生成物为一种,属于化合反应.(3)反应③Cu和C发生的还原反应。
2CuO;该反应中反应物有两种,生成物为一种,属于化合反应.(3)反应③Cu和C发生的还原反应。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】铜、铁是人类使用最早、应用广泛的金属.
(一)对古代制品的认识
青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
(1)上述制品不涉及到的材料是______(选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
(2)如图1为出土文物古代青铜铸件“马踏飞燕”.该文物能保存至今的原因可能是_____(选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(二)铁、铜的冶炼
①我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式:_________,2CuO+C![]() 2Cu+CO2↑.
2Cu+CO2↑.
②铁、铜矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等.CuFeS2为二硫化亚铁铜,其中S元素的化合价为______.
(1)工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为______________.
炼铁不采用黄铁矿、黄铜矿,可能的原因是:
①黄铁矿、黄铜矿含铁量相对低;②________________________________.
(2)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4![]() 4CuSO4+2Fe2(SO4)3+2H2O.
4CuSO4+2Fe2(SO4)3+2H2O.
向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu.
①发生主要反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4,________________________.
②FeSO4溶液经蒸发浓缩、___________、过滤等操作得到FeSO47H2O晶体.
(三)黄铜矿中铁、铜含量的测定
在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe2O3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO4、Fe2(SO4)3溶液.向溶液中加入过量NaOH溶液得到Cu(OH)2、Fe(OH)3固体.
(1)证明NaOH溶液过量的方法:静置,向上层清液中滴加________溶液,无现象.
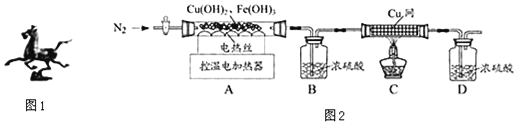
(2)用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH)2分解为CuO;在500℃时,Fe(OH)3分解为Fe2O3.
②在1400℃时,CuO分解为Cu2O和O2,Fe2O3分解为复杂的铁的氧化物和O2.
(1)装配好实验装置后,先要________________.
(2)停止加热后仍需继续通N2,可防止倒吸和______________________________.
(3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
温度/℃ | 室温 | 100 | 550 | 1400 |
B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%=________;ω(Fe)%=__________.
②复杂的铁的氧化物化学式为__________.
【题目】.为测定某石灰石样品中碳酸钙的质量分数,某同学取30g石灰石样品,把200g稀盐酸逐次加入其中,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
稀盐酸质量/g | 50g | 50g | 50g | 50g |
余下固体质量/g | 20g | 10g | 9g | 9g |
试求:(1)此石灰石样品的纯度。(2)200g稀盐酸中所含氯化氢的质量。