题目内容
【题目】为测定某铁合金样品(除铁外,其余成分不溶于水,且不参与任何反应)中单质铁的含量,小冰同学进行实验如下:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____;
(2)样品中单质铁的质量分数为_____;
(3)根据已知条件列出求解加入的稀硫酸中溶质质量(x)的比例式为_____;
(4)最终所得到的不饱和溶液中溶质的质量分数为_____;
(5)若用含氧化铁80%的赤铁矿炼出上述实验中所需要的铁合金160t,则理论上需要赤铁矿的质量为_____.
【答案】 Fe+H2SO4═FeSO4+H2↑ 70% ![]() =
=![]() 10.1% 200t
10.1% 200t
【解析】本题考查了根据化学方程式和化学式的计算。分析实验过程中数据的含义是解题的关键。
(1)铁能够与硫酸反应生成硫酸亚铁和氢气,方程式为Fe+H2SO4═FeSO4+H2↑;
(2)样品中单质铁的质量分数=![]() =70%;
=70%;
铁的质量=8g﹣2.4g=5.6g
设稀硫酸中溶质的质量是x,生成硫酸亚铁的质量为y.
Fe+H2SO4═FeSO4+H2↑;
56 98 152
5.6g x y
![]() =
=![]()
x=9.8g
![]() =
=![]()
y=15.2g
(3)根据已知条件列出求解加入的稀硫酸中溶质质量(x)的比例式为:![]() =
=![]()
(4)溶液中水的质量为100g﹣9.8g+44.6g=134.8g,故溶液的溶质质量分数为![]() ×100%=10.1%;
×100%=10.1%;
(5)设需要铁矿石的质量是z
z×80%×![]() =160t×70%
=160t×70%
z=200t

 全能练考卷系列答案
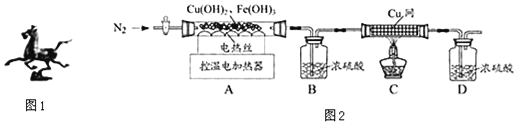
全能练考卷系列答案【题目】铜、铁是人类使用最早、应用广泛的金属.
(一)对古代制品的认识
青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
(1)上述制品不涉及到的材料是______(选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
(2)如图1为出土文物古代青铜铸件“马踏飞燕”.该文物能保存至今的原因可能是_____(选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(二)铁、铜的冶炼
①我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式:_________,2CuO+C![]() 2Cu+CO2↑.
2Cu+CO2↑.
②铁、铜矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等.CuFeS2为二硫化亚铁铜,其中S元素的化合价为______.
(1)工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为______________.
炼铁不采用黄铁矿、黄铜矿,可能的原因是:
①黄铁矿、黄铜矿含铁量相对低;②________________________________.
(2)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4![]() 4CuSO4+2Fe2(SO4)3+2H2O.
4CuSO4+2Fe2(SO4)3+2H2O.
向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu.
①发生主要反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4,________________________.
②FeSO4溶液经蒸发浓缩、___________、过滤等操作得到FeSO47H2O晶体.
(三)黄铜矿中铁、铜含量的测定
在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe2O3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO4、Fe2(SO4)3溶液.向溶液中加入过量NaOH溶液得到Cu(OH)2、Fe(OH)3固体.
(1)证明NaOH溶液过量的方法:静置,向上层清液中滴加________溶液,无现象.
(2)用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH)2分解为CuO;在500℃时,Fe(OH)3分解为Fe2O3.
②在1400℃时,CuO分解为Cu2O和O2,Fe2O3分解为复杂的铁的氧化物和O2.
(1)装配好实验装置后,先要________________.
(2)停止加热后仍需继续通N2,可防止倒吸和______________________________.
(3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
温度/℃ | 室温 | 100 | 550 | 1400 |
B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%=________;ω(Fe)%=__________.
②复杂的铁的氧化物化学式为__________.