题目内容
取22.2g石灰石样品,放入盛有146g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质质量变为159.4g.计算
(1)生成气体的质量为多少克?
(2)石灰石中碳酸钙的质量分数?
(3)稀盐酸中溶质的质量分数?
(1)生成气体的质量为多少克?
(2)石灰石中碳酸钙的质量分数?
(3)稀盐酸中溶质的质量分数?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:石灰石的质量与稀盐酸的质量和去掉烧杯内剩余物质的质量所得的质量是生成二氧化碳的质量.
由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出石灰石中碳酸钙的质量、稀盐酸中溶质的质量分数和生成氯化钙的质量.进而计算出石灰石中碳酸钙的质量分数.
由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出石灰石中碳酸钙的质量、稀盐酸中溶质的质量分数和生成氯化钙的质量.进而计算出石灰石中碳酸钙的质量分数.
解答:解:(1)生成二氧化碳的质量为:146g+22.2g-159.4g=8.8g;
设石灰石中碳酸钙的质量为x,稀盐酸中溶质的质量分数为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x 146g×y 8.8g
=
,
=
x=20g,y=10%,
石灰石中碳酸钙的质量分数为
×100%≈90.1%
答:(1)生成气体的质量为8.8g.
(2)石灰石中碳酸钙的质量分数为90.1%;
(3)盐酸溶液中溶质的质量分数为10%;
设石灰石中碳酸钙的质量为x,稀盐酸中溶质的质量分数为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x 146g×y 8.8g
| 100 |
| x |
| 44 |
| 8.8g |
| 73 |
| 146g×y |
| 44 |
| 8.8g |
x=20g,y=10%,
石灰石中碳酸钙的质量分数为
| 20g |
| 22.2g |
答:(1)生成气体的质量为8.8g.
(2)石灰石中碳酸钙的质量分数为90.1%;
(3)盐酸溶液中溶质的质量分数为10%;
点评:本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则有关此反应认识不正确的是( )
| 物质 | M | N | Q | P |
| 反应前的质量g | 18 | 1 | 2 | 32 |
| 反应前的质量g | x | 26 | 2 | 12 |
| A、该变化的基本反应类型是化合反应 |
| B、反应后物质M的质量为13g |
| C、反应中N和 P的质量比为3:1 |
| D、物质Q可能是催化剂 |
 某化学兴趣小组的同学把光亮的细铁丝分别盘成螺旋状,进行如下实验
某化学兴趣小组的同学把光亮的细铁丝分别盘成螺旋状,进行如下实验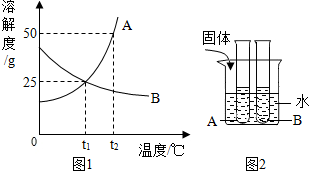 图1是A、B、两种固体物质的溶解度曲线,图2是将装有A、B两种物质饱和溶液的试管放入盛有t1℃水的烧杯中,根据图象和有关信息判断,回答以下问题.
图1是A、B、两种固体物质的溶解度曲线,图2是将装有A、B两种物质饱和溶液的试管放入盛有t1℃水的烧杯中,根据图象和有关信息判断,回答以下问题. 向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶液后,现象如图一所示.
向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶液后,现象如图一所示.