题目内容
【题目】纳米级Cu2O 因具有优良的催化性能备受关注.某兴趣小组开展了系列研究.
Ⅰ:纳米级Cu2O 的用途研究
(查阅资料)
②氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水.
③在纳米级Cu2O的催化作用下,氨气与氧气在一定温度下发生以下化学反应生成NO ,工业上用NO 制备硝酸、氮肥等化工产品.
(实验1)
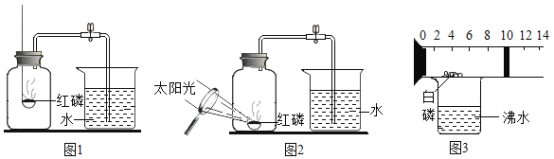
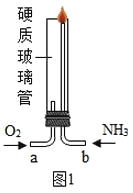
设计图1的实验装置验证氨气在氧气中燃烧:将过量的氧气与氨气分别从a 、b 两管进气口通入,并在b 管上端点燃氨气.实验组需先通入氧气,后通入氨气,理由是_____.
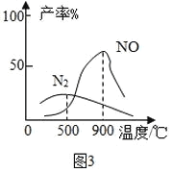
(实验2)设计如图2实验装置,根据气体成分分析数据,同学们绘制了曲线图(见图3),发现在纳米级Cu2O 的催化作用下,300℃时以生产_____为主.若利用后续处理装置模拟硝酸的工业制法,最好将电热丝的温度控制在_____℃左右.
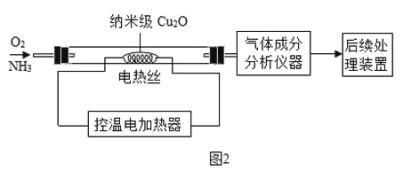
Ⅱ纳米级Cu2O的制备研究
利用某些特殊的细菌,在一定条件下将某岩石中的不溶性硫化铜(CuS )转化为可溶性硫化铜,进得纳米级Cu2O ,其流程如图4:
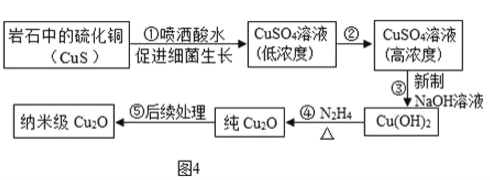
(1)在细菌作用下,岩石中的硫化铜(CuS )与空气中的氧气反应生成硫酸铜,反应的符号表达式为_____.
(2)③中观察到的现象是_____.
(3)物质所含元素化合价发生改变的反应称为氧化还原反应,在图4流程中,主要反应属于氧化还原反应的步骤是_____,Cu2O中铜元素的化合价是_____.
(4)经测定该岩石由硫化铜(CuS)和其他不含铜元素的物质组成.现用2000g该岩石制得43.2g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是_____g.若制得氧化亚铜Cu2O)的过程中,铜元素的总损耗为20%,通过计算确定该岩石中硫化铜(CuS)的质量分数_____(请写出计算过程).
【答案】NH3的燃烧需要高浓度氧气,先通氧气可以保证氨气被点燃 氮气 900 CuS+O2![]() CuSO4 产生蓝色沉淀 ①④ +1 38.4 3.6%
CuSO4 产生蓝色沉淀 ①④ +1 38.4 3.6%
【解析】
解:Ⅰ.[实验1] NH3的燃烧需要高浓度氧气,先通氧气可以保证氨气被点燃;
[实验2] 由图曲线可以看出,在300℃时氮气比NO产量高,以氮气为主;若利用后续处理装置模拟硝酸的工业制法,生成物中应以NO为主,因此最好将电热丝的温度控制在900℃左右;
Ⅱ.纳米级Cu2O的制备研究
(1)在细菌作用下,岩石中的硫化铜(CuS )与空气中的氧气反应生成硫酸铜,反应的符号表达式为CuS+O2![]() CuSO4;
CuSO4;
(2))③中反应是硫酸铜溶液中加入氢氧化钠,生成物中有氢氧化铜,因此可观察到产生蓝色沉淀;
(3)CuS到CuSO4硫元素的化合价从-2到+6;CuSO4和氢氧化钠反应生成氢氧化铜中元素的化合价都没发生改变;氢氧化铜到Cu2O铜元素的化合价从+2到+1;所以在图4流程中,主要反应属于氧化还原反应的步骤是①④;Cu2O中氧元素为-2价,根据化合物中正负化合价代数和为0可知铜元素化合价为+1价;
(4)Cu2O中铜元素质量为43.2g×![]() =38.4g;制得氧化亚铜(Cu2O)的过程中,铜元素的总损耗为20%,所以CuS中铜元素质量为
=38.4g;制得氧化亚铜(Cu2O)的过程中,铜元素的总损耗为20%,所以CuS中铜元素质量为![]() =48g,因此CuS的质量为
=48g,因此CuS的质量为![]() =72g,故该岩石中CuS的质量分数为
=72g,故该岩石中CuS的质量分数为![]() ×100%=3.6%。
×100%=3.6%。