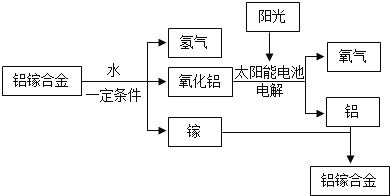
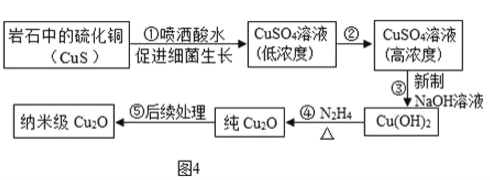
题目内容
【题目】某同学配制50g6%氯化钠溶液,整个操作过程如下图所示,回答下列问题:
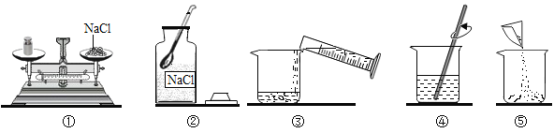
(1)配制溶液的正确操作顺序为____________(填序号,下同),其中操作错误的是____________。
(2)图②中盛放氯化钠固体的仪器名称是____________,需称取氯化钠____________g。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是____________(填序号)。
A氯化钠固体不纯 B用生锈砝码称量
C装瓶时有少量溶液洒出 D溶解时烧杯内壁有水珠
(4)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应____________。
A增加适量氯化钠固体 B减少适量氯化钠固体 C调节游码 D添加砝码
(5)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是________。
【答案】②①⑤③④ ① 广口瓶 3 AD B 加速溶解
【解析】
(1)配制配制50g 6%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,配制溶液的正确操作顺序为②①⑤③④.托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了。故填:②①⑤③④;①。
(2))图②中盛放氯化钠固体的仪器名称是广口瓶;溶质质量=溶液质量×溶质的质量分数,配制50g 6%氯化钠溶液,需氯化钠的质量=50g×6%=3g。故填:广口瓶;3。
(3)A、氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项符合题意。
B、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项不符合题意。
C、溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变,故选项不符合题意。
D、溶解时烧杯内壁有水珠,使得溶剂的质量增大,则使溶质质量分数偏小,故选项符合题意。
故填:AD。
(4)指针向左盘偏,说明左盘重,左盘加的是氯化钠,故要减少食盐氯化钠的量,故填:B。
(5)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,使用玻璃棒的目的是搅拌,加快溶解。故填:加速溶解。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】空气中氧气含量测定的再认识。
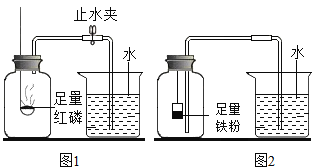
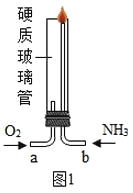
(实验回顾)图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的文字表达式_____;
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气体的_____减小,烧杯中水倒吸到集气瓶。
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测定结果与理论值往往相差较大。
(实验改进)
Ⅰ.甲同学根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量(装置中装铁粉的纸袋浸有浓食盐水,会加速铁生锈)
Ⅱ.测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)根据表中数据计算,改进后测得空气中氧气的体积分数是_____(结果精确到0.1%)。
(2)从实验原理角度分析,图2的实验结果比图1准确度更髙的主要原因是:_____、_____。
(实验反思)许多同学用改进前图1装置得出的结论却也与理论值相差较大,其主要原因是:_____。