题目内容
【题目】(1)某化合物在空气中燃烧后只生成CO2和H2O,判断该化合物中一定含有的元素是_____,可能含有_____元素;
(2)若该化合物是CH4 ,则反应的化学方程式为_____;
(3)若该化合物是CH3OH ,则反应的化学方程式为_____;
(4)用下图所示的方法测定该化合物的组成,得到数据如下图所示:
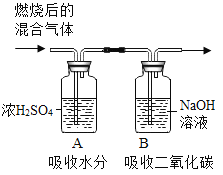
实验前后各装置的质量 | ||
装置 | 实验前 | 实验后 |
A | 150g | 153.6g |
B | 150g | 154.4g |
请据此计算该化合物中C、H元素的质量比为_____;
(5)以上实验中没有探究该化合物中究竟是否含有氧元素,请你设计一个实验以文字的形式简要的说明如何探究该化合物中是否含有氧元素_____。
【答案】C、H O CH4+2O2![]() 2CO2+2H2O 2CH3OH+3O2
2CO2+2H2O 2CH3OH+3O2![]() 2CO2+4H2O 3:1 先通过称量得到化合物的质量,用(4)中方法分别得到燃烧后生成的水和二氧化碳的质量,再通过计算获得化合物中氢元素和碳元素的质量,若两元素的质量之和等于化合物的质量说明该化合物中无氧元素;若小于化合物的质量,说明含氧元素
2CO2+4H2O 3:1 先通过称量得到化合物的质量,用(4)中方法分别得到燃烧后生成的水和二氧化碳的质量,再通过计算获得化合物中氢元素和碳元素的质量,若两元素的质量之和等于化合物的质量说明该化合物中无氧元素;若小于化合物的质量,说明含氧元素
【解析】
(1)根据质量守恒定律的宏观实质可得,化学反应前后元素种类不变,某化合物在空气中燃烧,是与空气中的氧气(氧气是由氧元素组成)反应,生成CO2和H2O,因此,化合物中一定含有的元素是C、H,是否还有氧元素,要通过反应前后的质量变化计算,氧元素只是可能含有,故填写:C、H;O;
(2)甲烷与氧气反应生成水和二氧化碳,故填写:CH4+2O2![]() 2CO2+2H2O;
2CO2+2H2O;
(3)乙醇与氧气反应生成水和二氧化碳,故填写:2CH3OH+3O2![]() 2CO2+4H2O;
2CO2+4H2O;
(4)由图可知,A中盛有浓硫酸,浓硫酸的作用是吸收水分,又由表中数据可得,生成水的质量为:153.6g-150g=3.6g,
水中氢元素的质量为:3.6g×![]() =0.4g,
=0.4g,
由于氧气中没有氢元素,所以,产物中氢元素全部来自于化合物中,故化合物中氢元素质量为0.4g,
由图可知,B中盛有氢氧化钠,氢氧化钠的作用是吸收二氧化碳,又由表中数据可得,生成二氧化碳的质量为:154.4g-150g=4.4g,
二氧化碳中碳元素的质量为:4.4g×![]() =1.2g,
=1.2g,
由于氧气中没有碳元素,所以,产物中碳元素全部来自于化合物中,故化合物中碳元素质量为1.2g,
该化合物中C、H元素的质量比为:1.2g:0.4g=3:1,故填写:3:1;
(5)先通过称量得到化合物的质量,用(4)中方法分别得到燃烧后生成的水和二氧化碳的质量,再通过计算获得化合物中氢元素和碳元素的质量,若两元素的质量之和等于化合物的质量说明该化合物中无氧元素;若小于化合物的质量,说明含氧元素,故填写:先通过称量得到化合物的质量,用(4)中方法分别得到燃烧后生成的水和二氧化碳的质量,再通过计算获得化合物中氢元素和碳元素的质量,若两元素的质量之和等于化合物的质量说明该化合物中无氧元素;若小于化合物的质量,说明含氧元素。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案