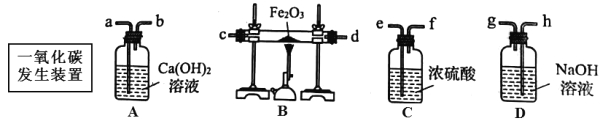
题目内容
【题目】分类是学习化学常用的方法。
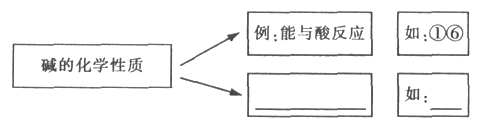
(1)物质的用途主要是由它们的性质决定的,请根据下列碱的用途所体现出物质的相关化学性质将它们分类,并参照实例完成空白处内容。(填一条即可)
①用氢氧化铝作胃药
②用石灰浆粉刷墙壁
③用熟石灰和纯碱反应制火碱
④用熟石灰制波尔多液
⑤用碱溶液吸收硫酸厂产生的二氧化硫
⑥工厂化验室用氢氧化钠溶液洗涤石油产品中的残余硫酸
(2)化学反应中有些反应没有明显现象,需要设计实验证明化学反应是否发生。请从反应物或生成物变化的角度,将下列实验中的A与_________(填“B”或“C”)归为一类,理由是__________________________________________________________________:。
|
|
|
A | B | C |
【答案】(1)能与某些非金属氧化物反应生成盐和水②⑤,可溶的碱能与某些可溶的盐反应生成新的盐和新的碱③④;(2)C 两者都是通过明显的现象证明有其它的物质生成
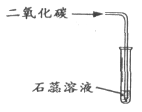
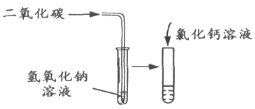
【解析】(1)碱的化学性质有:能与某些非金属氧化物反应生成盐和水②⑤,可溶的碱能与某些可溶的盐反应生成新的盐和新的碱③④;(2)A二氧化碳和水反应生成碳酸,碳酸使紫色石蕊试液变红;B加入盐酸后,溶液由红色变成无色,说明氢氧化钠能和盐酸反应;C二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠与氯化钙反应生成碳酸钙沉淀。AC都是通过反应的生成物的作用现象来判断,属于一类。B是通过反应物的变化而表现的现象判断的。

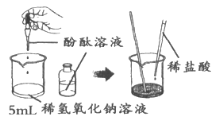
【题目】某实验小组的同学用氢氧化钠溶液和盐酸做中和反应的实验,当他们向盛有氢氧化钠溶液的烧杯中滴加一定量的稀盐酸后,发现忘记了滴加指示剂。他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行探究。
(1)写出该中和反应的化学方程式: 。
(2)探究烧杯内溶液中溶质的成分。
【猜想】猜想一:可能是NaCl和NaOH;猜想二:可能只有NaCl;
猜想三: 。
【进行实验】
实验步骤 | 实验操作 | 实验现象 | 结论 |
① | 取少量烧杯内的溶液于试管中,滴入几滴酚酞溶液,振荡 |
| 猜想一不成立 |
② | 取少量烧杯内的溶液于另一支试管中,滴加碳酸钠溶液 |
| 猜想三成立 |