题目内容
【题目】化学式一实验为基础的科学,实验室科学探究的重要手段。
(1)某化学兴趣小组的同学利用下图微型实验装置进行探究实验。
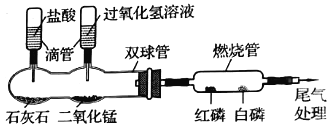
①写出一个双球管中可能反应的化学方程式。
②挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件?
③相同质量的磷、铁、镁分别在氧气中完全燃烧,消耗氧气最多的是_____。
(2)实验室可利用下图实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为:H2C2O4 ![]() H2O+CO2↑+CO↑
H2O+CO2↑+CO↑
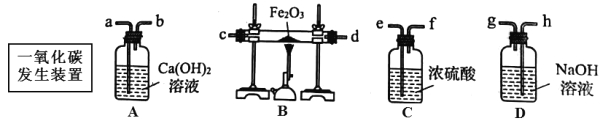
A装置中能观察到什么现象?
① 写出B装置中反应的化学方程式。
② 要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接_________、_______接_______、_______接_______、______接_______。
③ 从环保角度考虑,还需对以上装置进行改进,请简述改进措施。
(3)将30.9 g 氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却,称量,可以得到21.3 g 固体物质。请计算原固体混合物中氯酸钾的质量。
【答案】(1)①2HCl+CaCO3=CaCl2+H2O+CO2↑(或2H2O2 ![]() 2H2O+O2↑)
2H2O+O2↑)
②温度达到可燃物着火点,可燃物与氧气接触 ③磷
(2)①Ca(OH)2溶液变浑浊 ②Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
③h、g接e、f接c(或d)、d接(或c)b
④在A装置后增加一个尾气处理装置(合理即可)
(3)生成氧气的质量为30.9g-21.3g=9.6g,设原混合物中氯酸钾的质量为x
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 9.6g
![]() =
=![]() 解得x= 24.5g
解得x= 24.5g
【解析】(1)①碳酸钙和盐酸反应生成二氧化碳、氯化钙、水,过氧化氢在二氧化锰的作用下分解生成水和氧气,反应方程式分别为:2HCl+CaCO3=CaCl2+H2O+CO2↑(或2H2O2 MnO2 2H2O+O2↑)
②燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;此实验说明燃烧的条件:温度达到可燃物着火点,可燃物与氧气接触
③设1g磷、铁、镁分别在氧气中完全燃烧,消耗氧气的质量分别为x、m、n
4P + 5O2点燃2P2O5
124 160
1g x
124/1g=160/x x≈1.29g
2Mg + O2点燃2MgO
48 32
1g m
48/1g=32/m m≈0.67g
3Fe + 2O2点燃Fe3O4
168 64
1g n
168/1g=64/n n=0.38g; 消耗氧气最多的是磷(2)①二氧化碳能使Ca(OH)2溶液变浑浊 ②一氧化碳和氧化铁反应生成铁和二氧化碳,Fe2O3+3CO 高温 2Fe+3CO2 ③先除掉一氧化碳中可能混有的二氧化碳,然后用浓硫酸干燥一氧化碳,将一氧化碳通入还原金属氧化物的反应装置,然后吸收二氧化碳所以连接顺序是,h、g接e、f接c(或d)、d接(或c)b ;④一氧化碳会污染空气,所以应在A装置后增加一个尾气处理装置(合理即可)(3)生成氧气的质量为30.9g-21.3g=9.6g,设原混合物中氯酸钾的质量为x
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 9.6g
245/x=96/9.6g x=24.5g
答:略

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案