题目内容
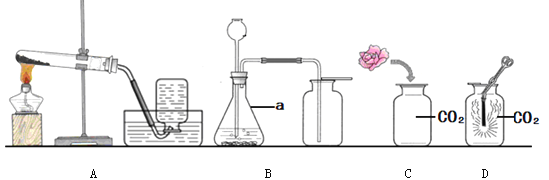
【题目】根据下列实验装置图,按要求回答有关问题:

(1)写出图中带有标号仪器的名称:a ___________;b ___________。
(2)实验室用加热高锰酸钾制取氧气时,应选择的发生装置是_____(填写装置的字母代号,下同),该装置有一处不足是__________,所发生反应的化学反应方程式为_________;基本反应类型为___________。
(3)实验室制取二氧化碳气体时,应选择的发生装置为______,应选用的收集装置是_____。检验二氧化碳是否收集满的方法是:将燃着的木条放在_________,观察火焰是否熄灭。
【答案】试管 长颈漏斗 A 试管口没有塞一小团棉花 2KMnO4![]() K2MnO4+MnO2+O2↑ 分解反应 B E 集气瓶口
K2MnO4+MnO2+O2↑ 分解反应 B E 集气瓶口
【解析】
(1)仪器a的名称是试管。仪器b的名称是长颈漏斗。
(2)实验室用加热高锰酸钾制取氧气的反应物的状态是固态,反应的条件是加热,故选固固加热型装置A。高锰酸钾分解的速率加快,可能将高锰酸钾粉末带入导管堵塞导管,故要在试管口放一团棉花。高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑。该反应是由一种物质反应生成多种物质,故是分解反应。
K2MnO4+MnO2+O2↑。该反应是由一种物质反应生成多种物质,故是分解反应。
(3)实验室制取二氧化碳的反应物的状态是固体和液体,反应的条件是不加热,故选固液不加热型装置B。二氧化碳能溶于水,密度比空气的密度大,故选向上排空气法装置E收集。该装置收集二氧化碳的验满方法是将燃着的木条放在集气瓶口,如木条熄灭,说明二氧化碳已满。

 全能练考卷系列答案
全能练考卷系列答案【题目】文献显示,卢西平等研究人员利用图1装置进行实验,探究二氧化锰的用量对过氧化氢溶液分解的影响。(压强传感器用于测量瓶内压强变化,各数据均于同温同压下测得,3%过氧化氢溶液的密度约为1 g /mL)

编号 | 第一组实验 | 第二组实验 | ||||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
过氧化氢溶液 | 8mL | 8mL | 8mL | 8mL | 8mL | 2mL | 4mL | 6mL | 8mL | 10mL |
二氧化锰 | 0.03g | 0.06g | 0.08g | 0.12g | 0.24g | 0.1g | 0.1g | 0.1 g | 0.1g | 0.1g |
第一组实验记录的瓶内压强变化如图2所示,第二组实验记录的瓶内压强变化如图3所示。

已知3%过氧化氢溶液中,过氧化氢占溶液总质量的3%。请根据以上实验回答下列问题:
(1)实验时,测定装置内反应的化学方程式为________。
(2)观察图2可知:该条件下30s内要完全分解8 mL3%过氧化氢溶液,至少要用___gMnO2。观察图3可知:该条件下0.1gMnO2至少能快速催化分解_____mL3%的过氧化氢溶液。
(3)综合第一组实验可以得出的结论是:其它条件不变时,MnO2的用量越大,过氧化氢完全分解耗时___,O2的产量______。综合第二组实验可以出的结论是:其它条件不变时,过氧化氢溶液的用量越大,O2的产量_____,过氧化氢完全分解耗时_______。
(4)综合两组实验可以推知:在这样的实验条件下要30s内完成反应,“二氧化锰与过氧化氢的质量比”最合适的取值约为_______。
【题目】如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
(1)以上两种物质的溶解度受温度影响较大的是_____。
(2)40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为_____g。
(3)20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)_____。