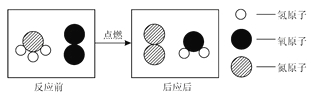
题目内容
【题目】(5分)在硫酸和氢氧化钠反应的过程中,下图是利用数字化传感器得到的溶液pH变化图像。
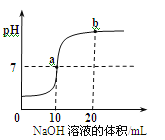
(1)反应的化学方程式为
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是 mL;
(3)图中b点所示溶液中,含有的溶质是 ;
(4)该实验中所用的稀硫酸是用浓硫酸稀释而来的,请写出稀释浓硫酸的操作方法___________;
(5)浓硫酸具有_________,所以可用作某些气体的干燥剂。
【答案】(1)2NaOH+H2SO4=Na2SO4+2H2O (2)10 (3)NaOH、Na2SO4
(4)将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌 (5)吸水性
【解析】
试题分析:(1)硫酸和氢氧化钠反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O
(2)当溶液呈中性时,即PH=7,根据图像,所消耗氢氧化钠溶液的体积是10
(3)图中b点表示溶液的PH>7,说明溶液显碱性,故所示溶液中,含有的溶质出了生成的Na2SO4,还有过量的NaOH
(4)由于浓硫酸稀释时会放出大量的热,故稀释浓硫酸的操作:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
(5)浓硫酸具有吸水性,所以可用作某些气体的干燥剂

练习册系列答案
相关题目