题目内容
【题目】某兴趣小组用修路材料石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他们将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
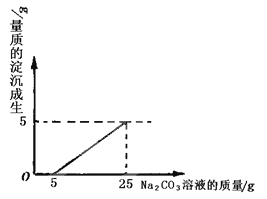
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有______________________;
(2)计算Na2CO3溶液中溶质的质量分数。(计算结果精确到0.1%)
【答案】(1)HCl (2)26.5%
【解析】
试题分析:石灰水和稀盐酸反应生成的是氯化钙、水和二氧化碳,由于不知道稀盐酸是否是否过量,若没有过量,那么溶液中只有氯化钙;若盐酸过量,那么溶液中的物质由氯化钙和盐酸两种。
(1)根据反应的图像开始加入碳酸钠时没有沉淀生成,说明溶液中出含有氯化钙外还含有盐酸;
(2)根据反应的图像可与盐酸反应消耗的碳酸钠溶液的质量为5g,与氯化钙反应消耗的碳酸钠溶液的质量为20g,生成的碳酸钙沉淀的质量为5g。利用化学方程式,根据碳酸钠与碳酸钙反应的质量比即可计算出20g碳酸钠溶液中碳酸钠的质量。
设20g碳酸钠溶液中溶质碳酸钠的质量为x,
Na2CO3+ CaCl2==2NaCl+CaCO3↓
106 100
X 5g
106/x =100/5g
X=5.3g
Na2CO3溶液中溶质的质量分数=5.3g/20g ×100%=26.5%
答:略

练习册系列答案
相关题目