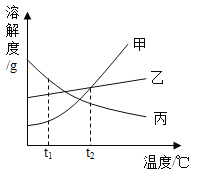
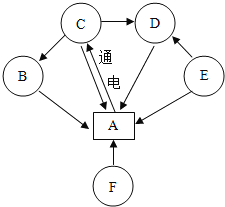
题目内容
【题目】电子工业常用30%的FeCl3溶液腐蚀覆盖有一薄层铜的绝缘板,制成印刷电路板。人们为了从废腐蚀液(含有CuCl2、FeCl2和FeCl3)中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
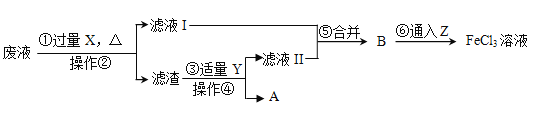
已知:2FeCl3+Fe=3FeCl2
(1)操作②、④的名称是_____;
(2)上述流程中,X的化学式为_____,加入过量的原因是_____,步骤③中有关反应的化学方程式为_____;
(3)Z为Cl2,第⑥步发生的反应为化合反应,此反应的化学方程式为_____。
【答案】过滤 Fe 使溶液中的氯化铁、氯化铜完全反应 Fe+2HCl═FeCl2+H2↑ 2FeCl2+Cl2═2FeCl3
【解析】
(1)操作②、④的名称是过滤,通过过滤把液体和不溶于水的固体分离;
(2)上述流程中,铁能和氯化铜反应生成氯化亚铁和铜,铁能和氯化铁反应生成氯化亚铁,所以加入的物质X是铁粉,化学式为:Fe,加入过量的原因是:使溶液中的氯化铁、氯化铜完全反应,步骤③中,加入的适量的Y是稀盐酸,稀盐酸能和铁反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑;
(3)Z为Cl2,第⑥步发生的反应为化合反应,氯化亚铁和氯气反应生成氯化铁,化学方程式为:2FeCl2+Cl2═2FeCl3。

【题目】用“盐酸—硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液呈酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
项目 | 单价(元/吨) |
NaOH | 6000 |
Na2S | 5000 |
辅助费用(以处理1吨H2S计) | 1114 |
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑,这种处理H2S的方法是______________(填“盈利”或“亏损”)的;
(2)“盐酸—硫化钡法”生产的BaCl2溶液中常会混有盐酸,为了测定该溶液中BaCl2的溶质质量分数,某同学做了如下实验:取该产品液10.0 g于烧杯中,逐滴滴入质量分数为5.3%的Na2CO3溶液至过量。记录滴入Na2CO3溶液的质量与有关量的变化关系如图1和图2所示:
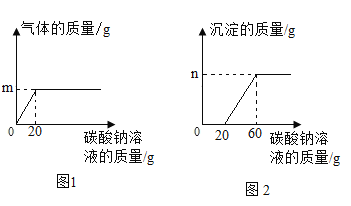
①m=________;n=________。
②与氯化钡反应的碳酸钠溶液的质量是________g。
③请计算该溶液中BaCl2的质量分数。(写出计算过程)