题目内容
【题目】铁、铜为日常生活中常见的金属.某化学兴趣小组的同学在探究金属的有关性质时,进行了如图实验:将A实验结束后①、②试管内的物质倒入烧杯中,一段时间后过滤.为确定烧杯内物质的成分,同学们做了如下两个实验:
(1)实验一:向滤渣中加入稀硫酸,无气泡产生,则滤渣中一定含有的物质是 .
(2)实验二:为确定滤液的成分,同学们设计了如下方案:
实验步骤 | 实验现象 | 结论 |
取少量滤液于试管中,向其中加入 | 有气泡产生,有红色固体析出 |
(3)该实验涉及的反应的化学方程式为 , .
(4)反思,有同学提出滤液中硫酸铜的确定不需要通过化学变化,原因是 . 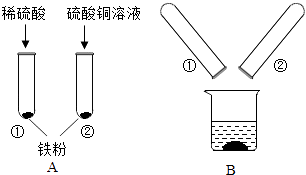
【答案】
(1)铜
(2)铁(或锌等);滤液中含有硫酸亚铁、硫酸和硫酸铜
(3)Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑
(4)观察颜色,若溶液为蓝色则含有硫酸铜
【解析】解:(1)向滤渣中加入稀硫酸,无气泡产生,说明没有铁,因此只有铁置换出来的铜;(2)向滤液中加入物质能产生气泡,并有红色固体析出,说明加入的是排在氢前面的金属,能够和硫酸反应产生氢气,和硫酸铜反应产生铜,因此滤液中含有硫酸、硫酸铜和混合前反应产生的硫酸亚铁,故填:铁(或锌);滤液中含有硫酸亚铁、硫酸和硫酸铜;(3)该实验涉及的反应有铁和硫酸铜反应产生硫酸亚铁和铜,和硫酸反应产生硫酸亚铁和氢气,故反应的方程式分别为:Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑;(合理即可)(4)硫酸铜溶液是蓝色溶液,因此可通过观察颜色,若溶液为蓝色则含有硫酸铜;所以答案是:观察颜色,若溶液为蓝色则含有硫酸铜.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.