题目内容
【题目】根据如图所示的A、B、C三种物质的溶解度曲线回答下列问题: 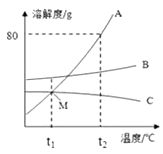
(1)t2℃时,在50g水中加入45g固体A,充分溶解后,得到的是溶液.
(2)升高温度可使物质(填“A”、“B”或“C”)的不饱和溶液变为饱和溶液.
(3)M点表示 .
(4)当A中混有少量B,可用法提纯A.
(5)t2℃时,将A、B、C的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数关系是 .
【答案】
(1)饱和
(2)C
(3)在t1℃时AC两物质的溶解度相等
(4)冷却A的热饱和溶液(降温结晶)
(5)B>A>C
【解析】解:(1)在t2℃时,A的溶解度是80g,也就是100g水中在该温度下最多溶解40gA,所以在50g水中加入45g固体A,充分溶解后,只能溶解40g,剩余5g,所以得到的是饱和溶液.(2)三种物质中只有C的溶解度随温度升高而减小,所以升高温度只能使 C物质的不饱和溶液变为饱和溶液,其他两物质的不饱和溶液会更加不饱和.(3)描述溶解度曲线交点意义时,体现温度以及对应的物质,强调是溶解度相等,所以M点表示:在t1℃时A、C两物质的溶解度相等.(4)由于AB两物质A的溶解度受温度影响变化较大,而B的溶解度受温度影响变化较小,所以当A中混有少量B,可用冷却A的热饱和溶液(降温结晶)法提纯A.(5)t2℃时,将A、B、C的饱和溶液分别降温至t1℃,此时A、B对应的溶液都是饱和溶液,所以关注t1℃时A、B两物质的溶解度,此时B的溶解度明显大于A的溶解度,而此时A的溶解度恰好位于M点,而C在此温度下是不饱和的,降温时也没有析出晶体,所以应该去考虑C的t2℃时溶解度,而C的t2℃时的溶解度小于C的t1℃时溶解度,也就A的t1℃时溶解度,所以此时溶质关系是B>A>C.所以所得溶液的溶质质量分数关系也就是 B>A>C. 故填:(1)饱和.(2)C.(3)在t1℃时AC两物质的溶解度相等.(4)冷却A的热饱和溶液(降温结晶).(5)B>A>C.
【考点精析】根据题目的已知条件,利用结晶的原理、方法及其应用和饱和溶液和不饱和溶液相互转变的方法的相关知识可以得到问题的答案,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂.

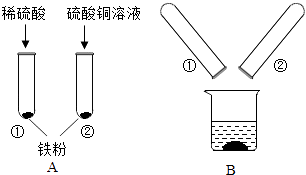
【题目】铁、铜为日常生活中常见的金属.某化学兴趣小组的同学在探究金属的有关性质时,进行了如图实验:将A实验结束后①、②试管内的物质倒入烧杯中,一段时间后过滤.为确定烧杯内物质的成分,同学们做了如下两个实验:
(1)实验一:向滤渣中加入稀硫酸,无气泡产生,则滤渣中一定含有的物质是 .
(2)实验二:为确定滤液的成分,同学们设计了如下方案:
实验步骤 | 实验现象 | 结论 |
取少量滤液于试管中,向其中加入 | 有气泡产生,有红色固体析出 |
(3)该实验涉及的反应的化学方程式为 , .
(4)反思,有同学提出滤液中硫酸铜的确定不需要通过化学变化,原因是 .