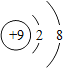题目内容
【题目】回答下列问题。
(1)“侯氏制碱法”制备Na2CO3的流程如下。
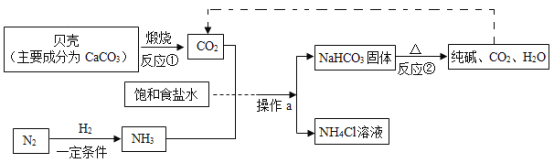
①反应②的化学方程式是___。
②操作a的名称是__,实验室进行此操作所需的主要玻璃仪器有烧杯、玻璃棒和____。
③流程图中能循环利用的物质是_(填化学式) ,副产品为_ ( 填化学式)。
(2)实验室制备纯碱( Na2CO3 )的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35°C,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表( g/100g水)
温度 溶解度 | 0°C | 10° C | 20° C | 30° C | 40° C | 50° C | 60°C | 100°C |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 一 | 一 | 一 | 一 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 16.4 | 一 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应温度需要控制在30~ 35°C ,原因是__。为控制此温度,通常采取的加热方法为___。
②保温30分钟,静置后只析出NaHCO3晶体的原因__。
【答案】![]() 过滤 漏斗 CO2 NH4Cl 该温度范围内,各物质溶解度最大,而又不会分解 水浴加热 该温度下, NaHCO3溶解度最小,其余物质溶解度较大,故只有NaHCO3析出
过滤 漏斗 CO2 NH4Cl 该温度范围内,各物质溶解度最大,而又不会分解 水浴加热 该温度下, NaHCO3溶解度最小,其余物质溶解度较大,故只有NaHCO3析出
【解析】
(1)①反应②是氨气、二氧化碳、水、和氯化钠反应生成氯化铵和碳酸氢钠,故的方程式为:![]()
②操作a是将固液分离,故是过滤。过滤过程中用到的玻璃仪器有玻璃棒、烧杯和漏斗。
③在流程中二氧化碳既是反应的反应物,又是反应的生成物,流程图中能循环利用的物质是二氧化碳。
(2)①根据表格的数据可知,30~ 35°C时,各物质溶解度最大,而又不会分解,故填:该温度范围内,各物质溶解度最大,而又不会分解
②由表可知,该温度下,碳酸氢钠的溶解度最小,其余物质溶解度较大,故只有NaHCO3析出。

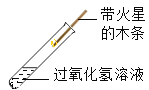
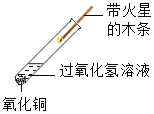
【题目】某化学兴趣小组对“氧化铜能否作过氧化氢分解的催化剂”进行了如下探究:
(实验探究)
实验编号 | 实验操作 | 实验现象 | 实验分析或结论 | |
实验分析 | 实验结论 | |||
① |
| 有少量气泡产生,木条不复燃 | 过氧化氢能分解,但是______ | 氧化铜是过氧化氢分解的催化剂 |
② |
| ________ | 氧化铜能加快过氧化氢的分解速率 | |
(1)写出实验②中发生的反应的化学方程式:___________________________________。
(交流反思)实验过程中加入两支试管中的过氧化氢溶液应满足的要求除了体积和温度相同之外,还要保证___________相同。
(2)小明同学认为仅由上述实验还不能完全得出表内的“结论”,他补充设计了以下两个探究实验。
实验一:称量反应后的固体质量,并与反应前的称量数据作比较,其目的是证明___________。
实验二:另取5 mL 5%的过氧化氢溶液于试管中,再向其中加入实验②反应后的固体剩余物,其余操作同实验②,其目的是证明___________;小明在进行实验时,发现试管内有许多水雾,由此推断过氧化氢分解是____(填“吸热”或“放热”)反应。
(实验拓展)小红同学用MnO2、CuO两种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,探究分解过氧化氢溶液制取氧气的适宜催化剂。
实验操作:取30粒含MnO2的海藻酸钠微球,采用图1装置进行实验。然后改用等量含另一种催化剂的海藻酸钠微球,重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
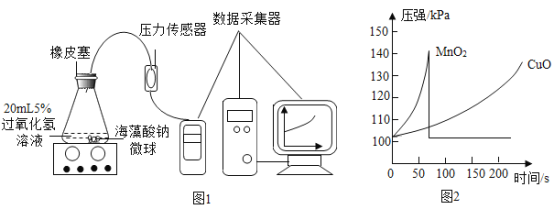
(3)每次实验时,海藻酸钠微球数应保持相同的原因是_________________________。
(4)用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_________________________。
(5)从实验曲线看,催化效果较好、反应温和的催化剂是_________________________。
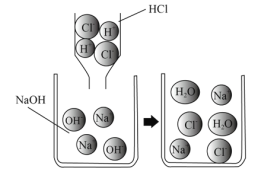
【题目】某化学兴趣小组的同学在做酸碱中和反应的实验时,向盛有氢氧化钙溶液的烧杯中加入一定量的稀盐酸后,忘了滴加酚酞溶液,不知道盐酸是否过量。于是他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行了探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想与假设]猜想一:溶质只有CaCl2
猜想二:_________________________。
猜想三:溶质中含有CaCl2和Ca(OH)2;
猜想四:溶质中含有CaCl2、HCl和Ca(OH)2。
[交流讨论]同学们讨论后一致认为猜想四不合理,理由是__________(用化学方程式表示)。
[查阅资料]氯化钙溶液呈中性。
[实验设计]同学们设计了如下不同的实验方案,请完成下列表格。
方案 | 操作步骤 | 实验现象 | 实验结论 |
一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
酚酞变红色 | 猜想三正确 | ||
二 | 取少量烧杯内的溶液于试管中,逐滴加入____________溶液至过量 | _____________ | 猜想二正确 |
[反思交流]方案一不能证明猜想一是否正确,理由是______________。若要完善此方案,可将酚酞溶液换成______________。
[拓展与应用]实验证明猜想二是正确的,要使烧杯内溶液的溶质只含有CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的__________,然后过滤。
[拓展延伸]在发生化学反应的过程中还伴随着温度的变化。室温下,将稀盐酸慢慢滴入装有氢氧化钙溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液的温度随加入稀盐酸的质量而变化的曲线如图所示:
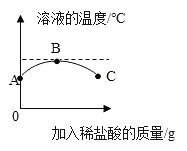
(1)由图可知,盐酸与氢氧化钙溶液发生的中和反应是_____________(填“吸热”“放热”或“无热量变化”)反应。
(2)向A点对应的溶液中加入紫色石蕊溶液,溶液呈_____________色。
(3)B点对应的溶液中的溶质是_______________(填化学式)。
(4)B到C的过程中溶液的pH逐渐________________(填“增大”“减小”或“无变化”)。
【题目】下列与化学有关的知识完全正确的一组是( )
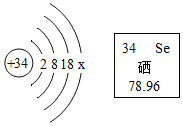
A | ①鉴别硝酸铵和硫酸铵——加熟石灰研磨,闻气味 ②吃水果——可以补充维生素 ③墙内开花墙外香——分子不断运动 | B | ① ②Mg2+——“2”表示一个镁离子带2个单位正电荷 ③C1O2中氯元素的化合价+4价 |
C | ①食品包装填充氧气——防止变质 ②加碘食盐——补充碘元素 | D | ①活性炭净水——吸附色素和异味 ②常用水冲洗铁制品——防止铁生锈 ③硬水和软水——加肥皂水可以区分 |
A.AB.BC.CD.D