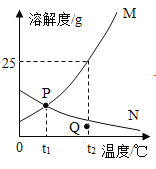
题目内容
【题目】氢氧化钠与稀盐酸反应观察不到明显现象,为了确定反应是否发生,丽丽小组同学设计了如下图所示的实验探究方案。
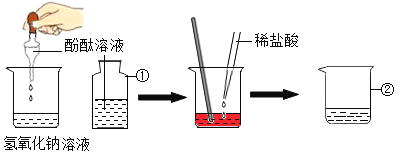
请回答下列问题:
(1)标号仪器的名称:①_____,②_____。
(2)玻璃棒在实验中的作用及目的_____。
(3)当观察到烧杯中溶液颜色_____时,说明酸碱恰好中和反应。
(4)该实验过程中发生反应的化学力程式_____。
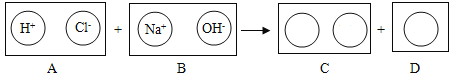
(5)仿照填写下用圆圈内的空白,其反应的实质是_____。
(6)若将50g质量分数7.3%的稀盐酸与50g质量分数8%的氢氧化钠溶液充分后,反应所得溶液的溶质质量分数是_____。
(7)酸、碱,盐水溶液导电是因为它们在水中溶解时能产成自由移动的离子,这个过程叫做电离。试着写出氢氧化钠的电离方程式_____。
(8)下列关于该实验方案中,能证明氢氧化钠与盐酸发生反应的序号是_____。
A 用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀盐酸,测得溶液的pH逐渐减小,最终小于7
B 用温度计测量氢氧化钠溶液在滴加稀盐酸前与后的温度,发现其明显上升
C 蒸发反应后所得的无色溶液得到白色的固体
D 向一定量NaOH溶液被中滴加稀盐酸、再滴加硫酸铜溶液,有蓝色沉淀生成
【答案】滴瓶 烧杯 搅拌,加速氢氧化钠溶液与盐酸反应,使反应更充分 刚好变为无色 ![]() H+与OH-结合生成H2O的过程 5.85% NaOH=Na++OH- AB
H+与OH-结合生成H2O的过程 5.85% NaOH=Na++OH- AB
【解析】
(1)①是滴瓶,②是烧杯。
(2)玻璃棒在实验中的作用及目的是搅拌,加速氢氧化钠溶液与盐酸反应,使反应更充分。
(3)当观察到烧杯中溶液颜色由红色刚好变为无色时,说明酸碱恰好中和反应。
(4)该实验过程中,稀盐酸和氢氧化钠反应生成氯化钠和水,发生反应的化学方程式为:![]() 。
。
(5)稀盐酸和氢氧化钠反应生成氯化钠和水,氯化钠在溶液中以钠离子和氯离子形式存在,如下图所示:

其反应的实质是H+与OH-结合生成H2O的过程。
(6)设反应生成氯化钠质量为x,
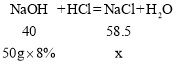
![]()
解得x=5.85g,
反应所得溶液的溶质质量分数为:![]() 。
。
(7)氢氧化钠电离生成自由移动的钠离子和氯离子,电离方程式为:![]() 。
。
(8)A 用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀盐酸,测定溶液的pH逐渐减小,最终小于7,说明氢氧化钠和稀盐酸发生了反应,符合题意;
B.用温度计测量氢氧化钠溶液在滴加稀盐酸前与后的温度,发现其明显上升,说明过程中放热,是由于氢氧化钠和稀盐酸反应放出热量,因此能够说明稀盐酸和氢氧化钠发生了反应,符合题意;
C.蒸发反应后所得的无色溶液得到白色的固体,不能说明稀盐酸和氢氧化钠发生了反应,这是因为蒸发氢氧化钠溶液时,能够得到白色固体氢氧化钠,不符合题意;
D.向一定量NaOH 溶液中滴加稀盐酸、再滴加硫酸铜溶液,有蓝色沉淀生成,不能说明稀盐酸和氢氧化钠发生了反应,这是因为氢氧化钠能和硫酸铜反应生成蓝色沉淀氢氧化铜,不符合题意。
故填:AB。

【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究二氧化锰能否加快过氧化氢分解 | 探究石蜡燃烧后是否有二氧化碳生成 | 检验氧气是否集满 | 测定空气中氧气的含量 |
A. A B. B C. C D. D