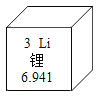
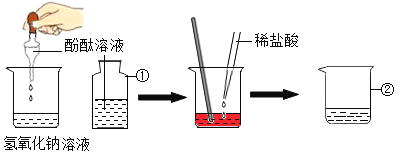
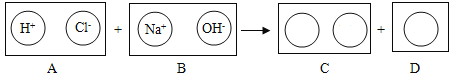
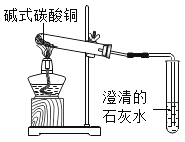
题目内容
【题目】如图是M、N两种固体物质的溶解度曲线,下列说法正确的是()
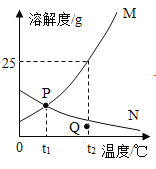
A.P点表示t1°C时M、N的饱和溶液中溶质质量相等
B.t2°C时100gM的饱和溶液中含有25gM
C.Q点对应的N溶液可通过降温变成P点对应的N溶液
D.t1°C时两物质的饱和溶液升温至t2°C,溶液中溶质质量分数M>N
【答案】D
【解析】
A、P点表示t1°C时M、N的溶解度相等,饱和溶液的质量未知,溶质质量不能确定,错误;
B、t2°C时M的溶解度是25 g,说明此时125 g M的饱和溶液中含有25 gM,错误;
C、Q点对应的N溶液为t2°C时N的不饱和溶液,P点对应的N溶液为t1°C时N的饱和溶液,且N的溶解度随温度升高而减小,通过降温的方法不能将Q点对应的N溶液变成P点对应的N溶液,错误;
D、M的溶解度随温度升高而增大,N的溶解度随温度升高而减小,将t1°C时两物质的饱和溶液升温至t2°C,得到t2°C时M的不饱和溶液,溶质质量分数与原t1°C时M的饱和溶液溶质质量分数相同,N的饱和溶液中有晶体析出,得到t2°C时N的饱和溶液,结合饱和溶液中溶质质量分数公式:![]() ,以及t1°C时M的溶解度>t2°C时N的溶解度,可知所得溶液中溶质质量分数大小关系为M>N,正确。
,以及t1°C时M的溶解度>t2°C时N的溶解度,可知所得溶液中溶质质量分数大小关系为M>N,正确。
故选D。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣。
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列三组实验(其他可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | — | |
② | 1.2g | 氧化铜0.5g | |
③ | 1.2g | 二氧化锰0.5g |
(1)上述实验应测量的“待测数据”是_____。
(2)若实验②比实验①的“待测数据”更_____(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(3)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到![]() 黑色粉末,说明_____。
黑色粉末,说明_____。
(4)再将黑色粉末放入试管中,加入_____,若观察到_____,说明黑色粉末的化学性质在反应前后保持不变。
(预期结论)氧化铜也能作氯酸钾分解的催化剂。
(评价设计)你认为小雨设计实验③和实验②对比的目的是_____。