题目内容
【题目】过碳酸钠俗称固体双氧水,其化学式为Na2CO4,广泛应用于洗涤、印染、纺织、造纸等领域。某化学兴趣小组同学取一定量的过碳酸钠样品,加入一定量的稀硫酸,发现产生大量气泡,同时得到无色溶液。同学们对得到的无色溶液中的溶质成分进行以下探究。
(温馨提示:实验中若涉及硫酸钙等微溶物,均视为可溶物)
[提出问题]溶液中溶质的成分是什么?
[查阅资料]过碳酸钠与水反应有两个过程:①![]() ;②过氧化氢在碳酸钠水解产生的氢氧根离子的催化作用下分解为水和氧气。
;②过氧化氢在碳酸钠水解产生的氢氧根离子的催化作用下分解为水和氧气。
[猜想与假设]
猜想一:Na2SO4;
猜想二:________________________________。
猜想三:Na2SO4、H2SO4;
猜想四:Na2SO4、H2SO4、Na2CO3。
其中不合理的猜想是_______________________,理由是_______________________。
[实验探究]
实验方案 | 实验操作 | 实验现象 | 实验结论 |
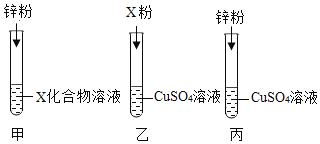
方案一 | 取少量溶液于试管中,滴加氯化钡溶液 | 有白色沉淀产生 | 猜想一成立 |
方案二 | 取少量溶液于试管中,滴加_______________溶液 | 有白色沉淀产生 | 猜想二成立 |
方案三 | 另取少量溶液于试管中,加入铁粉 | _______________________ | 猜想三不成立 |
[反思与评价]某同学提出,实验方案一不严谨,不能证明猜想一成立,原因是_______________________。
[拓展延伸]过碳酸钠在运输、保存中不能接触的物质有_______________________(填字母)。
A.稀盐酸
B.水
C.氯化钙溶液
D.氯化钠固体
【答案】Na2SO4、Na2CO3 猜想四 H2SO4与Na2CO3会发生化学反应 氯化钙(或硝酸钙) 无明显现象 上述猜想中都含有硫酸钠,硫酸钠与氯化钡溶液反应有白色沉淀生成 ABC
【解析】
[猜想与假设]过碳酸钠溶于水生成碳酸钠,向其中加人稀硫酸后,若二者恰好完全反应,则溶液中只含Na2 SO4;若硫酸过量,溶液中含有Na2SO4和H2 SO4;若碳酸钠过量,则溶液中含有Na2SO4和Na2 CO3,故猜想二为Na2 SO4、Na2 CO3碳酸钠能与稀硫酸反应,二者在同一溶液中不能共存,因此猜想四不合理。
[实验探究]根据实验结论“猜想二成立”,及实验现象“有白色沉淀产生”,可知所加溶液只与碳酸钠发生反应生成白色沉淀,故所加溶液中含有钙离子,如氯化钙、硝酸钙溶液;根据实验结论“猜想三不成立”,说明溶液中不含硫酸,因此加入铁粉后无明显现象。
[反思与评价]上述给出的猜想中都含有硫酸钠,故根据加人氯化钡溶液后,反应生成白色沉淀不能验证猜想一成立。
[拓展延伸]根据[查阅资料]可知过碳酸钠不可与水接触,故在运输、保存时不能接触含水的物质,稀盐酸、水和氯化钙溶液中都含有水,都不能接触;
故选ABC。

【题目】某兴趣小组同学利用下图装置进行相关实验。

(实验1)模拟炼铁实验
①若样品为氧化铁,则A中的实验现象是 ,反应的化学方程式是 。B中反应的化学方程式是 。
②该装置的不足之处是 。
(实验2)测定样品的组成
若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
2.32 g | 反应前55.72 g | 反应前 281.00 g |
反应后55.08 g | 反应后 281.56 g |
①兴趣小组同学经过讨论后认为应选用的数据是样品质量和装置A中玻璃管和固体的总质量,而不选用装置B的质量,理由是 。
②该样品所有可能的组成是 。
【题目】下列我国科技成果所涉及物质的应用中,体现物质物理性质的是
|
|
|
|
A 利用石墨烯优异的导电性,制成新型电阻触摸屏的电极 | B可燃冰是天然气水合物,作为新能源使用 | C 甲醇(CH3OH)低温制得氢气,用于新能源汽车 | D 优化煤的综合利用,发展煤制乙醇(C2H5OH)技术 |
A.AB.BC.CD.D