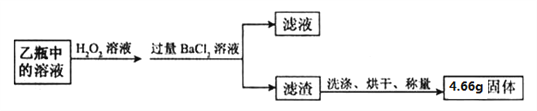
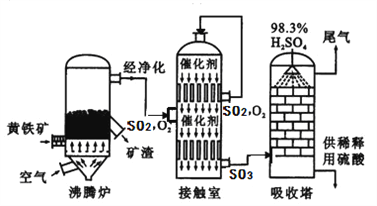
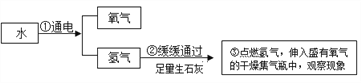
题目内容
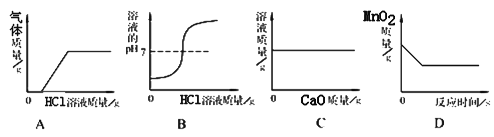
【题目】常温下,在饱和石灰水中加少量生石灰,溶液中的相关量随时间变化描述正确的是
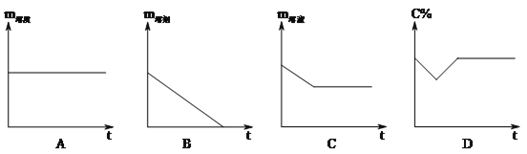
A. A B. B C. C D. D
【答案】D
【解析】A、石灰水中的溶质是氢氧化钙,氢氧化钙的溶解度随着温度的升高而减小,生石灰与水反应生成氢氧化钙,放出大量的热;
A、随着反应的进行,溶质质量减小,由于生石灰与水反应生成氢氧化钙,氢氧化钙的溶解度降低,等温度降低至常温后溶质的质量不再发生变化,错误;B、随着反应的进行,溶解度减小,溶质的质量减小,由于生石灰与水反应生成氢氧化钙,溶剂的质量较减小,但不会减小到0,错误;C、随着反应的进行,溶质质量减小,溶液质量减小,等温度降低至常温后恢复至原来的状态,错误;D、随着反应的进行,溶质质量减小,浓度减小,等温度降低至常温后恢复至原来的状态,正确。故选D。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
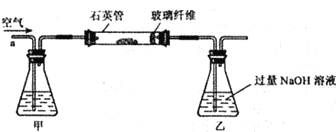
【题目】用下列装置对碳及其氧化物的性质进行系列实验探究。

实验 | 物质 | 问 题 | |
X | Y | ||
实验一 | CO | CuO | (1)实验开始前先通CO一段时间赶尽装置内空气。通过________________现象,可知装置内充满了CO气体。 (2)写出A处反应的化学方程式_________________,其中氧化铜发生_________(选填“氧化”或“还原”)反应。 (3)C中实验现象__________________。 (4)该实验能证明CO的化学性质是___________。 |
实验二 | CO2 | C | 写出A处反应的化学方程式________________,通过__________________现象,能证明该反应发生。 (2)B装置的作用是_______________。 (3)若2molC完全反应完,需要消耗________CO2。 I.1mol II. 2mol III. >2mol IV.无法判断 |