题目内容
【题目】规范的操作是试验成功的基本保证。下面是有些同学的实验操作,请根据要求回答下列问题:
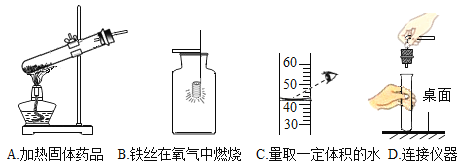
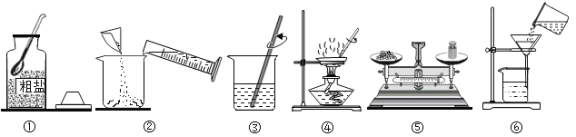
(1)A操作存在的错误是____;
(2)B操作中,铁丝燃烧的文字表达式为:____;把铁丝盘成螺旋状的理由是_____ ;
(3)用C操作读出的水的体积比实际体积________(填”偏大“或”偏小“);
(4)D操作可能造成的不良后果是_________。
【答案】试管口向上倾斜 铁+氧气![]() 四氧化三铁 增大铁丝与氧气的接触面积,使其充分反应 偏大 试管底部破裂
四氧化三铁 增大铁丝与氧气的接触面积,使其充分反应 偏大 试管底部破裂
【解析】
(1)加热固体内的试管药品时,试管口应略微向下;
(2)铁丝在氧气中反应原理:铁+氧气![]() 四氧化三铁;把铁丝盘成螺旋状的理由是增大铁丝与氧气的接触面积,使其充分反应。
四氧化三铁;把铁丝盘成螺旋状的理由是增大铁丝与氧气的接触面积,使其充分反应。
(3)量筒量取液体体积时:俯视读数测量值大于真实值;
(4)应该将试管拿起,不能将试管支撑在桌面上连接仪器,容易造成试管底部破裂;

 阅读快车系列答案
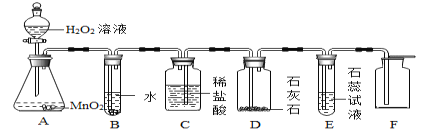
阅读快车系列答案【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
(假设)H2O2生成O2的快慢与催化剂种类有关。
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
(进行实验)下图是他们进行实验的装置图,气体发生装置中A仪器的名称是(1)_________,此实验中B处宜采用的气体收集方法是(2)_________。
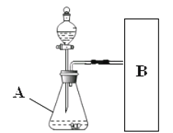
(实验记录)
实验编号 | 1 | 2 |
反应物 | 5%H2O2 | 5%H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165s | 46s |
(结论)该探究过程得出的结论是(3)_____________。
(反思)H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的(4)______和(5)______是否改变。
(实验拓展)H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入5mL 5%的过氧化氢溶液,然后加入等量的二氧化锰。 | 缓慢有少量气泡冒出 | (6)___________ |
另取一支试管加入5mL 15%的过氧化氢溶液,然后加入等量的二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入5mL 15%的过氧化氢溶液,把试管放入盛有冷水的烧杯中 | (9)______ | 温度越高,过氧化氢分解的速率越大 |
取一支试管加入5mL(7)___ 的过氧化氢溶液,把试管放入盛有(8)___ 的烧杯中 | (10)______ |