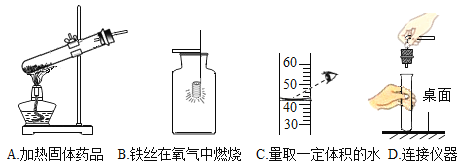
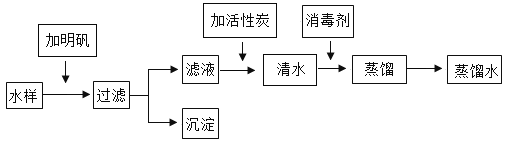
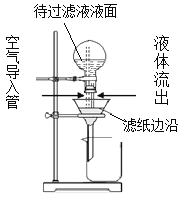
题目内容
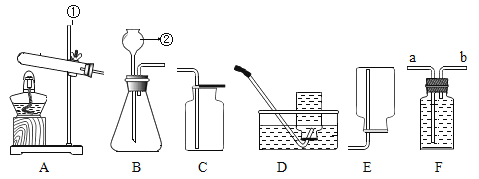
【题目】同学利用“多米诺骨牌“效应,设计了如下气体制取与性质验证的组合实验。打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出。请看图回答问题:
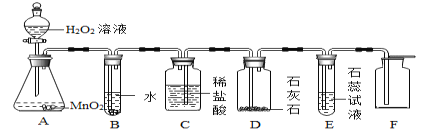
(1)C中看到的现象是 ______________________________ ;
(2)E中反应的化学式表达式为________________________;
(3)用F装置收集气体的依据是 ________________ 。检验F装置中气体是否收集满的方法是_______________________ 。
【答案】瓶中液面下降,稀盐酸被压入D装置中 ![]() 二氧化碳密度大于空气 将燃着的木条放在瓶口
二氧化碳密度大于空气 将燃着的木条放在瓶口
【解析】
(1)C中,气压增大,把稀盐酸压入D装置中,C中看到的现象是瓶中液面下降,稀盐酸被压入D装置中;
(2)二氧化碳进入E中,和水反应生成碳酸,碳酸能使石蕊试液变红色,反应的化学式表达式为:![]() ;
;
(3)用 F 装置收集二氧化碳,是因为二氧化碳密度比空气大;检验 F 装置中气体是否收集满的方法:把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分:
周期 族 | IA | 0 | ||||||
一 | 1H 1.008 | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 2He 4.003 |
二 | 3Li 6.941 | 4Be 9.012 | 5B 10.81 | 6C 12.01 | 7N 14.01 | 8O 16.00 | 9F 19.00 | 10Ne 20.18 |
三 | 11Na 22.99 | 12Mg 24.31 | 13Al 26.98 | 14Si 28.09 | 15P 30.97 | 16S 32.06 | 17Cl 35.45 | 18Ar 39.95 |
(1)12号元素的元素符号为_____;C元素的相对原子质量为_____。
(2)相对原子质量为22.99的元素属于_____(填“金属”或“非金属”);Ne的化学性质_____(填稳定或活泼)。氮原子的最外层电子数为_____。科学家宣布已人工合成了第116号元素,则此元素的核电荷数为_____。
(3)表中不同种元素最本质的区别是_____(填字母)
A 质子数不同 B 相对原子质量不同 C 中子数不同
(4)氧、氯、硫、磷在化学反应中一般易_____电子(填“得”或“失”),钠、铝、钾、钙在化学反应中一般易_____电子(填“得”或“失”)趋向达到相对稳定结构。
(
【题目】空气中氧气含量测定的再认识
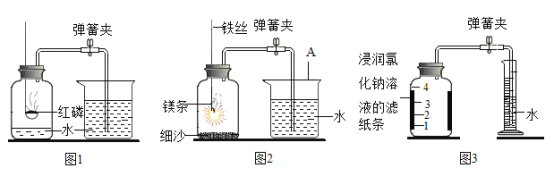
Ⅰ. 用红磷测定空气中氧气的含量。
(1)请写出红磷在空气中燃烧的化学式表达式___________________。
(2)如图1实验, 测得空气中氧气的体积含量小于1∕5,可能的原因是 _____(填序号)。
A燃烧匙伸入集气瓶太慢 B红磷量不足
C实验中发现导管口有气泡冒出 D装置漏气
Ⅱ. 用镁条测定空气中氧气的含量。
(3)请写出镁条在氧气中燃烧的化学式表达式 _____________________________ 。
(4)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。
已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。 但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是 _________ 。在操作规范的情况下,该同学实验所测得的氧气体积分数 _________ 1/5(填“大于”、“小于”或“等于”)。
Ⅲ. 用铁粉测定空气中氧气的含量。
(5)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出该反应的化学式表达式 _________ 。
(6)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图3实验,8分钟后测得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
250mL | 180.0mL | 129.5mL |
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是_________ 。根据表中数据计算得出空气中氧气的体积分数为_________(结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是 ______________ 。
【题目】空气中氧气含量测定的再认识。
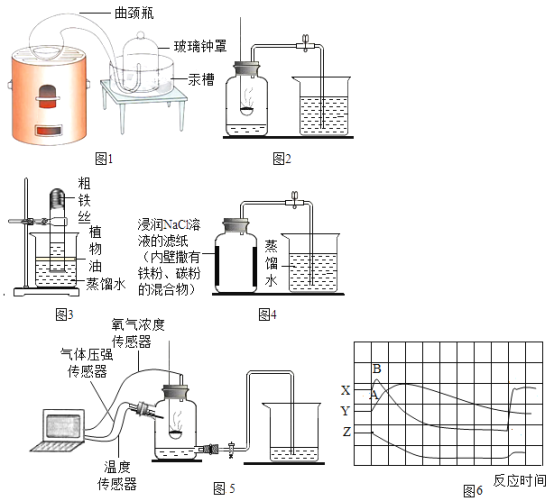
(1)(经典赏析)拉瓦锡用定量的方法研究空气的成分(实验装置如图1)。该实验中选择使用汞的优点有_______________。
A 实验过程中没有污染
B 能将密闭装置内空气中的氧气几乎耗尽
C 在汞槽中起到液封的作用
D 生成的化合物加热分解又能得到汞和氧气
(2)(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字表达式_______________。图2中集气瓶底部水的作用为_______________。(填字母)
A 吸收有害物质 B 降温,快速冷却但是用该方法测出的氧气含量常常低于21%。
(3)(提出问题)用该方法测出的氧气含量为什么低于21%?
(进行猜想)①_______________;②_______________,装置内氧气有剩余。
(4)(实验与交流)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测定了实验装置(如图5)内的压强、温度和氧气浓度,三条曲线变化趋势如图6所示。其中Y曲线表示的是_______________(填“温度”或“氧气的浓度”)。
(反思拓展)结合Y、Z两条曲线,解释如图6中AB段气压变化的原因是___________。
(5)(实验探究1)小明根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算出空气中氧气的含量为19.13%。
(交流与反思)与用红磷燃烧的方法相比,用铁丝生锈的方法的主要优点________(填字母)。
A 装置内残留的氧气更少
B 反应更彻底,实验结果更准确
C 铁丝生锈比红磷燃烧反应更快
(6)(实验探究2)小明利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:请计算出空气中氧气含量_________(计算结果保留一位小数)。相对于实验探究1,实验探究2能加快反应速率的原因是________。
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
(7)(拓展延伸)铜能与空气中氧气、水、二氧化碳反应生成铜绿[其主要成分为:![]() 。请你预测:若将图3中的铁丝换成足量的铜丝,能否比较准确地测定空气中氧气的含量_____________,预测依据是_____________(填字母)。
。请你预测:若将图3中的铁丝换成足量的铜丝,能否比较准确地测定空气中氧气的含量_____________,预测依据是_____________(填字母)。
A 空气中![]() 含量只有约0.03%,铜不能将装置内约21%的氧气几乎耗尽
含量只有约0.03%,铜不能将装置内约21%的氧气几乎耗尽
B 铜丝反应比铁丝快
C 反应更彻底