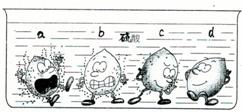
题目内容
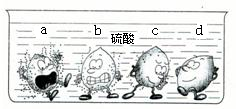 学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是
(2)将金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如右表所示.则它们的金属活动性由强到弱的顺序为(
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
B.Z Ni Y Mn X
C.X Mn Y Ni Z
D.X Mn Ni Y Z
(3)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.请你写出下列用金属氧化物制取金属的化学方程式:
①金属氧化物加热分解:
②用碳还原金属氧化物:
(4)查阅资料:在金属活动性顺序里,位于氢后面的金属铜在常温下虽然不能与稀盐酸、
稀硫酸反应,但可以与浓硫酸在加热时发生反应,其反应的化学方程式为:
Cu+2H2SO4(浓)?CuSO4+SO2↑+2H2O
反应生成的SO2是一种无色、能溶于水、有刺激性气味的气体.若用该方法制取硫酸铜,应用
(5)请你利用所学知识设计一种以铜、稀硫酸为主要原料制取硫酸铜的方法.(用化学方程式表示)
(6)向12.8g铜中加入40g浓硫酸溶液,恰好完全反应,计算生成SO2的质量(方程式见上)和反应前硫酸溶液中溶质的质量分数.
分析:(1)观察图中放入稀硫中的四种金属表面气泡的多少,判断金属的活动性;
(2)根据实验结果判断金属活动性顺序;
(3)根据所述的反应规律,选择熟悉的反应,写出反应的化学方程式;
(4)二氧化碳气体是有毒气体,根据其能与碱溶液反应,可选择氢氧化钠溶液进行吸收,以防止造成污染;
(5)设计实验,完成铜到硫酸铜的转化.根据铜的性质,可进行:Cu→CuO→CuSO4的转化;
(6)根据反应的化学方程式,利用铜的质量计算生成物二氧化碳的质量和消耗硫酸的质量,最后求出原稀硫酸溶液中质量分数.
(2)根据实验结果判断金属活动性顺序;
(3)根据所述的反应规律,选择熟悉的反应,写出反应的化学方程式;
(4)二氧化碳气体是有毒气体,根据其能与碱溶液反应,可选择氢氧化钠溶液进行吸收,以防止造成污染;
(5)设计实验,完成铜到硫酸铜的转化.根据铜的性质,可进行:Cu→CuO→CuSO4的转化;
(6)根据反应的化学方程式,利用铜的质量计算生成物二氧化碳的质量和消耗硫酸的质量,最后求出原稀硫酸溶液中质量分数.
解答:解:(1)金属与酸放出气体速率越大,金属的活动性越强,反之则反.
图中,金属d表现无气泡,说明该金属不能和稀硫酸反应,在金属活动顺序表中就处于H之后;
故选D;
(2)由实验结果可知:Ni的活动性小于X、Y,大于Z;Mn的活动性小于X,大于Y、Z;
则五种金属中,X的活动性最强,Z的活动性最弱,从强到弱的顺序为X>Ni>Y>Ni>Z;
故选C;
(3)①此类反应不多,红色粉末氧化汞受热,分解成金属汞并释放出氧气;
故答:2HgO
2Hg+O2↑;
②碳在高温条件下性质较活泼,能还原一些金属氧化物如氧化铜等,生成红色铜同时放出气体二氧化碳;
故选C+2CuO
2Cu+CO2↑(其他合理答案均可).
(4)二氧化碳为非金属氧化物,可与碱溶液如氢氧化钠溶液反应,生成亚硫酸钠和水,有毒气体二氧化碳被吸收,减少对空气造成的污染;
故答:氢氧化钠(NaOH);防止生成的二氧化硫污染空气;
(5)利用金属铜在加热时可以与氧气生成黑色氧化铜,对铜进行加热,把得到的黑色氧化铜放入稀硫酸,氧化铜与硫酸反应后就可以得到硫酸铜;
故答:2Cu+O2
2CuO;CuO+H2SO4(稀)═CuSO4+H2O;
(6)设:生成SO2的质量为X,消耗H2SO4的质量为Y
Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
64 196 64
8g Y X
64:64=12.8g:X,解之得 X=12.8g
64:196=12.8g:Y,解之得 Y=39.2g
硫酸溶液中溶质的质量分数为:
×100%=78.4%
答:生成SO2的质量为12.8g,硫酸溶液中溶质的质量分数为78.4%.
图中,金属d表现无气泡,说明该金属不能和稀硫酸反应,在金属活动顺序表中就处于H之后;
故选D;
(2)由实验结果可知:Ni的活动性小于X、Y,大于Z;Mn的活动性小于X,大于Y、Z;
则五种金属中,X的活动性最强,Z的活动性最弱,从强到弱的顺序为X>Ni>Y>Ni>Z;
故选C;
(3)①此类反应不多,红色粉末氧化汞受热,分解成金属汞并释放出氧气;
故答:2HgO
| ||
②碳在高温条件下性质较活泼,能还原一些金属氧化物如氧化铜等,生成红色铜同时放出气体二氧化碳;
故选C+2CuO
| ||
(4)二氧化碳为非金属氧化物,可与碱溶液如氢氧化钠溶液反应,生成亚硫酸钠和水,有毒气体二氧化碳被吸收,减少对空气造成的污染;
故答:氢氧化钠(NaOH);防止生成的二氧化硫污染空气;
(5)利用金属铜在加热时可以与氧气生成黑色氧化铜,对铜进行加热,把得到的黑色氧化铜放入稀硫酸,氧化铜与硫酸反应后就可以得到硫酸铜;
故答:2Cu+O2
| ||
(6)设:生成SO2的质量为X,消耗H2SO4的质量为Y
Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
64 196 64
8g Y X
64:64=12.8g:X,解之得 X=12.8g
64:196=12.8g:Y,解之得 Y=39.2g
硫酸溶液中溶质的质量分数为:
| 39.2g |
| 50g |
答:生成SO2的质量为12.8g,硫酸溶液中溶质的质量分数为78.4%.
点评:活动性强的金属能把活动性弱的金属从其盐溶液中置换出来,反之,能把金属从其盐溶液中置换出来,说明金属活动性强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是______.
(2)将金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如右表所示.则它们的金属活动性由强到弱的顺序为(______)
A.Z Mn Y Ni X
B.Z Ni Y Mn X
C.X Mn Y Ni Z
D.X Mn Ni Y Z
(3)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.请你写出下列用金属氧化物制取金属的化学方程式:
①金属氧化物加热分解:______ 2Hg+O2↑
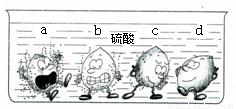
(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是______.
(2)将金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如右表所示.则它们的金属活动性由强到弱的顺序为(______)
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
B.Z Ni Y Mn X
C.X Mn Y Ni Z
D.X Mn Ni Y Z
(3)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.请你写出下列用金属氧化物制取金属的化学方程式:
①金属氧化物加热分解:______ 2Hg+O2↑

 学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
学过金属的活动性顺序以后,东东对其一系列知识进行了研究. 学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
学过金属的活动性顺序以后,东东对其一系列知识进行了研究. 4Al2O3+9Fe.
4Al2O3+9Fe.