题目内容
【题目】水是生命之源,工业、农业、生活等各方面都离不开水。
I、下列物质加入水中能形成溶液的是_________,能形成乳浊液的是_________。(填序号)
a.植物油 b.硫酸铜 c.泥土
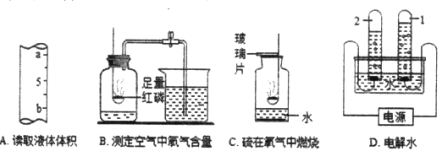
II、下图是实验室用溶质质量分数为10%的氢氧化钠溶液进行水的电解实验。

实验一:配制200g溶质质量分数为10%氢氧化钠溶液
(1)所需氢氧化钠的质量是______g;
(2)称量时,氢氧化钠固体应放于天平____(填“左”或“右”)盘上的_______内;量取所需的水时(水的密度为1g/cm3),应选择的量筒的规格是_______mL(选填“100”、“200”或“250”)。
实验二:水的电解实验
(3)用如图所示装置进行水的电解实验。已知氢氧化钠在水的电解过程中,只是起到了_____________的作用。实验前管1和管2内都装满溶液,接通电源,一段时间后,两管内产生的气体情况如图所示,则管2下方的电极应连接电源的________极(填“正”或“负”),用__________的方法可验证2管中的气体。写出电解水的化学方程式:_____________。
(4)该实验能说明的事实是:___________________________。
(5)电解后溶液的溶质质量分数_____10%(填“<”、“=”或“>”)。
【答案】 b a 20 左 烧杯 200 增强溶液的导电性 负 点燃 略 水是有氢元素和氧元素组成的 >
【解析】I、在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物属于溶液,硫酸铜易溶于水,形成均一、稳定的混合物,属于溶液;植物油不溶于水,与水混合形成乳浊液;
II、(1)氢氧化钠的质量是200g×10%=20g;
(2)天平使用时要“左物右码”,氢氧化钠固体有强腐蚀性,应放于天平左盘上的玻璃器皿(如烧杯)内;需要水的质量为200g-20g=180g,水的密度为1g/cm3,所以水的体积为180mL,量取所需的水时,应选择的量筒的规格是200mL。
(3)电解水时,加入氢氧化钠,目的是增强溶液的导电性;生成氢气和氧气的体积比为2:1,管2中的气体为氢气,与电源的负极相连;氢气具有可燃性,可用点燃的方法验证;电解水的化学方程式为:2H2O ![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)电解水实验能说明水是有氢元素和氧元素组成的;
(5)电解后,水减少,氢氧化钠的质量不变,溶液的溶质质量分数变大,所以溶液的溶质质量分数>10%。

 名校课堂系列答案
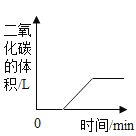
名校课堂系列答案【题目】某同学用如图装置,进行有关碳及其氧化物的实验(图中夹持已略去),在完成气密性检査后加入药品,并已在装置中充满二氧化碳。

(1)填写表格中的空白内容:
实验步骤 | 实验现象 | 实验分析 |
①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 | 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且______ | 硬质玻璃管中发生反应的化学方程式为:___________ |
②点燃B处酒精喷灯,加热一段时间 | B处玻璃管内___________ | 以上实验说明___________具有还原性 |
③停止通入二氧化碳,熄灭A、B两处的火焰 | C中有D中液体进入 | / |
(2)有同学认为该装罝需要添加尾气处理装置,你认为是否需要并说明理由___________.