题目内容
【题目】请根据如图所示的实验过程和提供的数据(②产生气体全部逸出)回答问题: 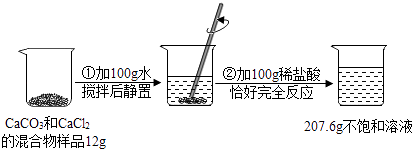
(1)恰好反应时生成的气体的质量为克.
(2)原混合物12克样品中CaCl2质量是克.
(3)实验中所用盐酸的溶质质量分数是多少?请写出规范的格式.
【答案】
(1)4.4
(2)2
(3)解:实验所用稀盐酸的溶质的质量分数为: ![]() ×100%=7.3%
×100%=7.3%
【解析】解:(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g, 设原混合物中 CaCO3的质量为x,稀盐酸中氯化氢的质量y
CaCO3+ | 2HCl═CaCl2+H2O+ | CO2↑ |
100 | 73 | 44 |
x | Y | 4.4g |
![]()
解得:x=10g
y=7.3g(2)所以原混合物样品中CaCl2的质量为:12g﹣10g=2g
(1)根据图中信息可以知道,反应前加入的物质的总质量为:12g+100g+100g=212g,而反应后剩余物质的总质量为207.6g,根据质量守恒定律可以知道物质减少的质量为生成二氧化碳的质量;(2)根据二氧化碳的质量结合化学方程式可以求算出碳酸钙的质量,进而可以求出氯化钙的质量;(3)根据二氧化碳的质量结合化学方程式可以求算出碳酸钙的质量,可以据此求算出盐酸的质量分数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目