题目内容
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10 g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出氧化碳气体且质量与加入稀盐酸的质量关系如右图所示。试求:
(1)样品中碳酸钠的质量是多少?
(2)样品与足量的稀盐酸反应后生成氯化钠的质量是什么?
(3)样品中氢氧化钠的质量分数是多少?
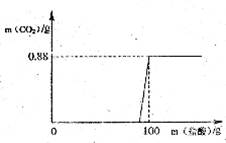
解:设Na2CO3的质量为x,与Na2CO3反应HCl的质量为y,生成的NaCl的质量为z
Na2CO3+2HCI=2NaCl+ CO2+H2O
106 73 117 44
x y z 0.88g
![]() x=2.12g
x=2.12g
![]() y=1.46g
y=1.46g
![]() z=2.34g
z=2.34g
又设NaOH质量为m,它与HCl反应生成NaCl的质量为n
NaOH +HCl == NaCl+ H2O
40 36.5 58.5
m 100g×7.3%-l.46g n
=5.84g
![]() m=6.4g
m=6.4g ![]() n=9.36g
n=9.36g
所以,生成氯化钠的总质量为2.34g+9.36g=11.7g
样品中氢氧化钠的质量分数为6.4/10g=64%
答:(略)

练习册系列答案
相关题目
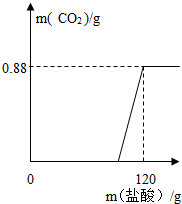 有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求: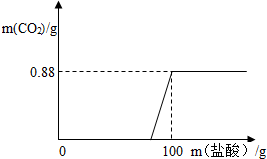 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
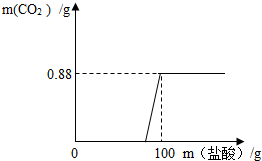 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.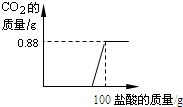 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求: