题目内容
氢氧化钠是一种重要的化工原料,工业上常用电解饱和食盐水的方法来制取烧碱、氯气(Cl2)和氢气.(1)写出工业上电解饱和食盐水的化学方程式
(2)盛氢氧化钠溶液的试剂瓶口可能会出现白色的碳酸钠粉末,用化学方程式表示其原理.如何证实白色粉末中含有碳酸钠?
(3)为了探究NaOH和CO2确实发生了化学反应,某实验小组的同学设计出了下列4种实验装置,请回答下列问题:
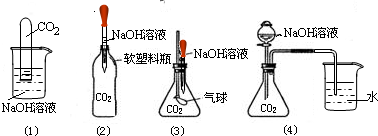
选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因.
选择的实验装置是装置
实验现象为:
产生该实验现象的原因是:
(4)稀盐酸和氢氧化钠溶液发生复分解反应时,无明显的现象,设计实验证明稀盐酸和氢氧化钠溶液发生了反应.
(5)有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加一定溶质质量分数的稀盐酸,放出气体的质量为0.88g.试求:样品中氢氧化钠的质量分数是多少?
分析:氢氧化钠能吸收空气中的二氧化碳生成碳酸钠,所以在瓶口处有碳酸钠粉末.氢氧化钠吸收二氧化碳会使装置内的压强变小,压强小于大气压时液面会上升.
解答:解:由题干所给信息可以读出反应物与生成物及反应条件.可以写电解食盐水的化学方程式.
氢氧化钠能吸收空气中的二氧化碳,产生碳酸钠,所以只需证明有碳酸根就能说明氢氧化钠变质了就行了.
所以可滴加盐酸来验证氢氧化钠是否变质.
我们还可以根据产生的二氧化碳气体的质量来计算样品中氢氧化钠的质量.
故答案为:
(1)2NaCl+2H2O
2NaOH+H2↑+Cl2↑
(2)2NaOH+CO2═Na2CO3+H2O将白色粉末加入盐酸,若有气泡产生则可证实有Na2CO3.
(3)
二氧化碳溶解于水,使气体的量减少,也可以出现类似的现象
(4)取氢氧化钠溶液少许,滴加1到2滴酚酞溶液,溶液显红色,逐滴滴加稀盐酸,红色消失,证明稀盐酸和氢氧化钠溶液发生了反应.
(5)解:设混合物中Na2CO3的质量为x.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.88g
=
x=2.12g
样品中氢氧化钠的质量分数为:
(10g-2.12g)÷10g×100%=78.8%
答:样品中氢氧化钠的质量分数为78.8%.
氢氧化钠能吸收空气中的二氧化碳,产生碳酸钠,所以只需证明有碳酸根就能说明氢氧化钠变质了就行了.
所以可滴加盐酸来验证氢氧化钠是否变质.
我们还可以根据产生的二氧化碳气体的质量来计算样品中氢氧化钠的质量.
故答案为:
(1)2NaCl+2H2O
| ||
(2)2NaOH+CO2═Na2CO3+H2O将白色粉末加入盐酸,若有气泡产生则可证实有Na2CO3.
(3)
| 装置(1) | 装置(2) | 装置(3) | 装置(4) | |
| 实验现象 | 试管内液面上升,烧杯内液面下降. | 软塑料瓶变瘪 | 气球胀大 | 烧杯内的水流入锥形瓶中 |
| 产生实验现象的原因 | 二氧化碳与氢氧化钠溶液反应,使试管内压强减少,液体被压入试管中 | 二氧化碳与氢氧化钠溶液反应,使塑料瓶内压强减少,大气压将软塑料瓶压瘪了. | 二氧化碳与氢氧化钠溶液反应,使锥形瓶内压强减少,大气压使气球胀大. | 二氧化碳与氢氧化钠溶液反应,使锥形瓶内压强减少,大气压将液体压入锥形瓶中. |
(4)取氢氧化钠溶液少许,滴加1到2滴酚酞溶液,溶液显红色,逐滴滴加稀盐酸,红色消失,证明稀盐酸和氢氧化钠溶液发生了反应.
(5)解:设混合物中Na2CO3的质量为x.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.88g
| 106 |
| 44 |
| x |
| 0.88g |
x=2.12g
样品中氢氧化钠的质量分数为:
(10g-2.12g)÷10g×100%=78.8%
答:样品中氢氧化钠的质量分数为78.8%.
点评:氢氧化钠在空气中易潮解,也能吸收空气中的二氧化碳,生成碳酸钠而变质.我们在检验是否变质时,只需检验有碳酸根即可.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目