题目内容
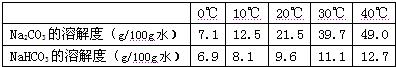
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
要除去NaHCO3固体中的少量Na2CO3,应采用的物理方法是( )
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| A.冷却结晶 | B.蒸发结晶 | C.溶解过滤 | D.加适量盐酸 |

分析溶解度表可知:Na2CO3的溶解度随温度的升高而升高,且受温度影响较大;NaHCO3的溶解度随温度的升高而升高,但受温度影响变化不大.所以要出去NaHCO3固体中的少量Na2CO3,可将固体溶于水,采用蒸发结晶法.
故选B
故选B

练习册系列答案
相关题目
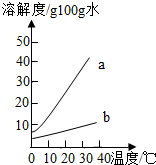 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为
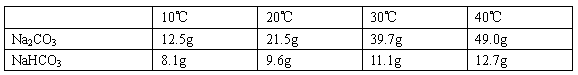
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
Ⅰ.冷却结晶Ⅱ.蒸发结晶Ⅲ.溶解过滤
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是
(4)40℃时的100.0g Na2CO3的饱和溶液中含有
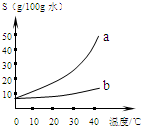 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
①冷却热饱和溶液 ②蒸发溶剂 ③溶解过滤
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是
(4)40℃时的100g Na2CO3的饱和溶液中含有
(5)若将30%的碳酸钠溶液100g,稀释到10%,需要加水
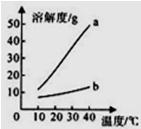

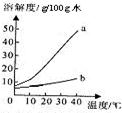 6、以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
6、以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.