题目内容
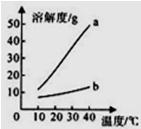
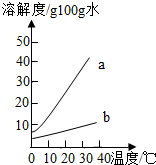 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为
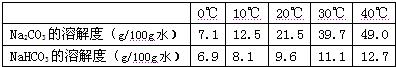
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
Ⅰ.冷却结晶Ⅱ.蒸发结晶Ⅲ.溶解过滤
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是
(4)40℃时的100.0g Na2CO3的饱和溶液中含有
分析:(1)根据表中数据,判断两物质溶解度受温度影响的大小,判断溶解度曲线;
(2)对比两物质溶解度受温度影响情况,判断除去NaHCO3固体中的少量Na2CO3可采取的方法;
(3)利用Na2CO3转化为NaHCO3的反应,推断要除去NaHCO3饱和溶液中的少量Na2CO3,可采用的化学方法;
(4)查出40℃时Na2CO3的溶解度,利用溶解度的数值含义,分析40℃时的100.0g Na2CO3的饱和溶液的组成及配制所需溶质、溶剂的量.
(2)对比两物质溶解度受温度影响情况,判断除去NaHCO3固体中的少量Na2CO3可采取的方法;
(3)利用Na2CO3转化为NaHCO3的反应,推断要除去NaHCO3饱和溶液中的少量Na2CO3,可采用的化学方法;
(4)查出40℃时Na2CO3的溶解度,利用溶解度的数值含义,分析40℃时的100.0g Na2CO3的饱和溶液的组成及配制所需溶质、溶剂的量.
解答:解:(1)由表中数据可知,碳酸钠的溶解度从0℃时的7.1g到40℃的49g,受温度影响大于碳酸氢钠;因此,曲线a为Na2CO3溶解度曲线;
(2)由于碳酸钠的溶解度受温度影响大而碳酸氢钠的溶解度受温度影响不大,因此,要除去NaHCO3固体中的少量Na2CO3,应采用蒸发结晶的方法;
(3)根据Na2CO3能与二氧化碳反应而转化为NaHCO3的反应为Na2CO3+CO2+H2O═2NaHCO3,因此,要除去NaHCO3饱和溶液中的少量Na2CO3,可向溶液中通入过量的CO2;
(4)40℃时Na2CO3的溶解度为49g,此时碳酸钠的饱和溶液中溶质与溶液的质量比为49:149,因此,40℃时的100.0g Na2CO3的饱和溶液中含溶质质量=100.0g×
=32.9g,饱和溶液的溶质质量分数=
×100%=32.9%;配制该溶解需要水的质量=100.0g-32.9g=67.1g合67.1mL;
故答案为:(1)a;(2)II;(3)通入过量的CO2;(4)32.9;32.9%;32.9g;67.1.
(2)由于碳酸钠的溶解度受温度影响大而碳酸氢钠的溶解度受温度影响不大,因此,要除去NaHCO3固体中的少量Na2CO3,应采用蒸发结晶的方法;
(3)根据Na2CO3能与二氧化碳反应而转化为NaHCO3的反应为Na2CO3+CO2+H2O═2NaHCO3,因此,要除去NaHCO3饱和溶液中的少量Na2CO3,可向溶液中通入过量的CO2;
(4)40℃时Na2CO3的溶解度为49g,此时碳酸钠的饱和溶液中溶质与溶液的质量比为49:149,因此,40℃时的100.0g Na2CO3的饱和溶液中含溶质质量=100.0g×
| 49 |
| 149 |
| 49 |
| 149 |
故答案为:(1)a;(2)II;(3)通入过量的CO2;(4)32.9;32.9%;32.9g;67.1.
点评:根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
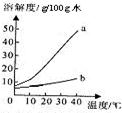
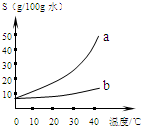 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为
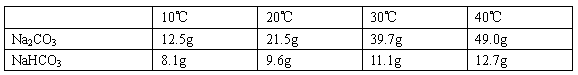
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
①冷却热饱和溶液 ②蒸发溶剂 ③溶解过滤
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是
(4)40℃时的100g Na2CO3的饱和溶液中含有
(5)若将30%的碳酸钠溶液100g,稀释到10%,需要加水

 6、以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
6、以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.