题目内容
【题目】化学是在分子、原子层次上研究物质的科学。根据下图中提供的信息,请回答下列问题:
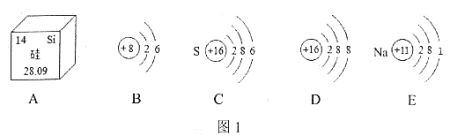
(1)由A图可知,硅原子的核外电子数为___________;
(2)B、C、D、E中属于同种元素的是_____________(填字母序号),原因是它们的___________相同;
(3)B所示粒子在化学反应中容易____________电子(填“得到”或“失去”);其化学性质与__________ (填字母序号)相似;
(4)由C、E两种元素组成的化合物的化学式为___________。
(5)图2为元素周期表的部分,甲、乙代表两种不同元素,以下判断正确的是___________。
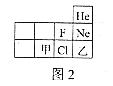
A 甲的原子序数大于乙
B 甲和Cl在同一周期
C 乙和He的最外层电子数相同
【答案】14 CD 质子数 得到 C Na2S B
【解析】
(1)由元素周期表方格信息可知硅元素的原子序数为14,根据原子序数=核电荷数=核内质子数=14,在原子中质子数又等于核外电子数,可知硅原子的核外电子数为14,故填14;
(2)是否为同种元素取决于核电荷数(质子数)是否相同,质子数相同的为同种元素,质子数不同的属于不同种元素,C和D的质子数相同,属于同种元素,故填CD;
(3)B所示粒子最外层电子数为6,大于4,在化学反应中容易得到电子形成阴离子,故填得到;元素化学性质和最外层电子数关系最为密切,最外层电子数相同的原子化学性质相似,BC原子最外层电子数相同为6,化学性质相似,故填BC;
(4)元素C质子数是16,为硫元素,最外层电子数是6,易得到2个电子形成带2个单位负电荷的硫离子,E元素质子数为11,是钠元素,原子最外层电子数是1,易失去1个电子形成带1个单位正电荷的钠离子,根据化合物中各元素化合价代数和为零,可知CE形成化合物的化学式为硫化钠,化学式为:Na2S;
(5)根据元素周期表和题图可知,
A、元素周期表中同周期元素原子序数数从左向右依次增大,甲的原子序数小于乙,选项不正确;
B、处于元素周期表中同一横行的元素属于同一周期元素,甲和Cl在同一周期,选项正确;
C、乙和He虽然处于同一族,但由于乙位于第三周期,是氩元素,最外层电子数是8电子的稳定结构,而氦只有1个电子层,是2电子的稳定结构,乙和He的最外层电子数不同,选项不正确;
故填B。